La Proteina Spike del COVID-19 è Patogena ”Sia dall’mRNA del virus che da quello del vaccino”
La pandemia COVID-19 ha causato molte malattie, molti decessi e un profondo sconvolgimento della società. La produzione di vaccini “sicuri ed efficaci” era un obiettivo fondamentale per la salute pubblica. Purtroppo, gli alti tassi di eventi avversi senza precedenti hanno messo in ombra i benefici. Questa revisione narrativa in due parti presenta le prove dei danni diffusi dei nuovi prodotti COVID-19 mRNA e adenovectorDNA e rappresenta una novità nel tentativo di fornire una panoramica completa dei danni derivanti dalla nuova tecnologia dei vaccini che si basano su cellule umane che producono un antigene estraneo che ha prove di patogenicità. Questo primo lavoro esplora i dati sottoposti a revisione paritaria che contrastano con la narrativa “sicura ed efficace” legata a queste nuove tecnologie.
La patogenicità della proteina spike, definita “spikeopatia”, sia che provenga dal virus SARS-CoV-2 sia che sia prodotta dai codici genetici del vaccino, simile a un “virus sintetico”, è sempre più compresa in termini di biologia molecolare e fisiopatologia. La trasfezione farmacocinetica attraverso tessuti corporei distanti dal sito di iniezione da parte di nanoparticelle lipidiche o vettori virali significa che la “spikeopatia” può colpire molti organi. Le proprietà infiammatorie delle nanoparticelle utilizzate per trasportare l’mRNA; la N1-metilpseudouridina impiegata per prolungare la funzione dell’mRNA sintetico; la diffusa biodistribuzione dei codici dell’mRNA e del DNA e delle proteine spike tradotte e l’autoimmunità attraverso la produzione umana di proteine estranee contribuiscono agli effetti nocivi. Questo articolo passa in rassegna gli effetti autoimmuni, cardiovascolari, neurologici, i potenziali effetti oncologici e le prove autoptiche della spikeopatia. Con la pianificazione di molte tecnologie terapeutiche basate sui geni, una rivalutazione è necessaria e tempestiva.
1. Introduzione
In questa revisione narrativa, esaminiamo le prove solide per una contro-narrazione del messaggio “sicuro ed efficace” che ha accompagnato i nuovi vaccini COVID-19, che sono stati sviluppati a “velocità di curvatura” con la grande speranza di porre fine alla pandemia. Queste prove si sono accumulate e hanno smorzato l’ottimismo iniziale. Le implicazioni per il riconoscimento delle diagnosi correlate al vaccino e la necessità di terapie sono significative per tutti gli operatori sanitari e per molti ricercatori.
Le aree problematiche principali sembrano essere: (1) la tossicità della proteina spike, sia dal virus sia quando viene prodotta dai codici genetici dei nuovi vaccini COVID-19 a mRNA e adenovectorDNA [1,2], da cui il nuovo termine “spikeopatia”; (2) le proprietà infiammatorie di alcune nanoparticelle lipidiche utilizzate per trasportare l’mRNA [3]; (3) la presenza di N1-metilpseudouridina nell’mRNA sintetico che causa un’azione di lunga durata [4]; (4) la diffusa biodistribuzione dei codici mRNA [5] e DNA [6,7] attraverso le matrici lipidiche-nanoparticelle e i vettori virali, rispettivamente e (5) il problema delle cellule umane che producono una proteina estranea nei nostri ribosomi che può generare autoimmunità [8,9].
La comparsa della SARS-CoV-2 alla fine del 2019 e della malattia associata COVID-19, dichiarata dall’OMS come pandemia globale entro marzo 2020, ha causato molte malattie e molti decessi negli anziani e nelle persone a rischio e ha seriamente sconvolto la società.
Un’ampia revisione della letteratura sulle pubblicazioni tra dicembre 2019 e agosto 2021 ha rivelato che il maggior rischio di mortalità dovuto alla COVID-19 è associato a malattie cardiovascolari, cerebrovascolari e renali croniche [10]. La produzione di vaccini sicuri ed efficaci per fermare la pandemia di COVID-19 è stato uno degli interventi più importanti per la salute pubblica. Molti vaccini COVID-19 sono stati sviluppati in tutto il mondo. Nei Paesi non occidentali, la maggior parte dei vaccini ha utilizzato tecnologie tradizionali a base di proteine o di virus inattivati. I vaccini a mRNA e adenovettore-DNA sono stati prodotti da grandi aziende farmaceutiche e favoriti dalle autorità di regolamentazione nella maggior parte dei Paesi occidentali. È stato ampiamente affermato che questi vaccini hanno salvato milioni di vite. Si nutrono sincere speranze in questo senso. Ma questa convinzione si basa in gran parte sulle prime stime del tasso di mortalità per infezione (IFR) e sulle affermazioni di efficacia di Pfizer, Moderna, AstraZeneca e Janssen, che sono state minate da nuovi dati.
L’uso dei vaccini basati sui geni è stato oggetto di controversie e questo articolo ne esplora le ragioni. Per soddisfare il desiderio diffuso di vaccini “sicuri ed efficaci”, la tecnologia basata sui geni offre una rapida velocità di produzione. La speranza ha forse influenzato gran parte della letteratura pubblicata e la narrazione dei media. Una questione centrale è stata la crescente evidenza di effetti patogeni della proteina spike della SARS-CoV-2, sia come parte del virus sia prodotta da codici genetici nei vaccini a mRNA e adenovettore-DNA.
Lo scopo di questa revisione narrativa è quello di presentare un resoconto completo della patogenicità dell’antigene, della biodistribuzione dei codici genetici per l’antigene in tutto il corpo, della loro natura modificata di lunga durata, in particolare con i vaccini a mRNA, e della letteratura e dei dati che mostrano gli eventi avversi che ci si aspetterebbe da tale biodistribuzione e produzione cellulare di un antigene estraneo. La rassegna presenta un caso di traduzione prematura di una tecnologia sperimentale di terapia genica in una vaccinazione pubblica di massa e questioni etiche e normative che devono essere esaminate e riformate prima della prossima pandemia.
La valutazione dei rischi di una malattia rispetto ai rischi e ai potenziali benefici di un intervento è fondamentale per le decisioni individuali di consenso informato e per le politiche di salute pubblica. Visti i rischi dei nuovi vaccini COVID-19 basati sui geni, ne valeva la pena alla luce della gravità dell’infezione da SARS-CoV-2? Affrontiamo prima i rischi del COVID-19.
2. Modellizzazione del COVID-19 rispetto ai dati del mondo reale
È evidente che il ceppo originale di Wuhan e le prime varianti di SARS-CoV-2 nel 2020 erano più patogene delle varianti successive. Ciò è coerente con la tipica evoluzione adattativa virale verso ceppi più infettivi ma meno patogeni, un fenomeno naturale fortunato per l’umanità. L’affermazione che i vaccini COVID-19 abbiano salvato molti milioni di vite è basata su una modellizzazione basata sui tassi di mortalità dei casi (CFR) in Cina nel febbraio 2020, pubblicata da Verity et al. su The Lancet [11]. Gli autori hanno stimato un CFR del 6,4% (5,7-7,2) nelle persone di età superiore ai 60 anni e “fino al 13,4% (11,2-15,9) nelle persone di età pari o superiore agli 80 anni… con un rapporto di mortalità per infezione complessivo per la Cina dello 0,66% (0,39-1,33)” (abstract). Fortunatamente, il virus è mutato e queste previsioni dei modelli non si sono concretizzate quando la pandemia si è sviluppata nei tre anni successivi.
I vaccini COVID-19 hanno salvato vite umane, ma non è chiaro quante. L’affermazione di milioni di vite salvate dai vaccini basati sul gene COVID-19 si basava in parte sull’ipotesi che i vaccini COVID-19 proteggessero dall’infezione e dalla trasmissione, cosa che non è avvenuta perché l’immunità sistemica ai virus respiratori non è efficace quanto l’immunità mucosale dall’infezione, e a causa della continua evoluzione delle varianti, forse in parte guidata dall’evasione adattativa degli anticorpi indotti dal vaccino. Pfizer ha ammesso che il suo studio clinico di fase 3 [12] non ha testato la trasmissione virale [13].
Tuttavia, le presunzioni di efficacia sono state sostenute dai modellatori COVID-19 e ribadite dalle autorità sanitarie, dalle pubblicazioni mediche e dai media. Lo dimostrano Watson et al. (2022) in “Global impact of the first year of COVID-19 vaccination: a mathematical modelling study”, pubblicato su The Lancet Infectious Diseases [14]. Gli autori stimano circa 14,4 milioni di vite salvate in relazione ai benefici della vaccinazione che includono la protezione contro l’infezione e la trasmissione, entrambe ora riconosciute come infondate. Questa stima supponente di Watson et al. persiste come un fatto accettato, mentre i dati sul tasso di mortalità per infezione (IFR) del mondo reale parlano contro la necessità di vaccinare i non anziani.
In breve, all’inizio del 2020 Roussel et al. hanno presentato un’analisi statisticamente significativa che paragonava il tasso di mortalità per SARS-CoV-2 a quello di precedenti coronavirus e malattie simil-influenzali: Nei Paesi OCSE, il tasso di mortalità per la SARS-CoV-2 (1,3%) non era significativamente diverso da quello dei coronavirus comuni identificati negli ospedali pubblici di Marsiglia, Francia (0,8%; p = 0,11) [15]. Se la modellizzazione si fosse basata su questi dati pochi mesi dopo i dati iniziali cinesi, si sarebbero fatte proiezioni diverse, più in linea con le statistiche di mortalità eventuali, anche nel 2020, prima della disponibilità del vaccino.
Ioannidis et al. nel 2022, in un articolo intitolato “Forecasting for COVID-19 has failed” (Le previsioni per il COVID-19 sono fallite), hanno criticato i modelli che hanno ignorato i bassi IFR che sarebbero emersi nella prima metà del 2020 [16]. Ioannidis et al. hanno osservato che:
“Il fallimento nella previsione delle epidemie è un vecchio problema. In effetti, è sorprendente che la previsione delle epidemie abbia mantenuto molta credibilità tra i responsabili delle decisioni, visti i suoi dubbi precedenti. I modelli per l’influenza suina prevedevano 3100-65.000 morti nel Regno Unito . (consultato il 2 giugno 2020). Alla fine si sono verificati 457 decessi (governo britannico, 2009)”.
[16] (p. 425)
Ioannidis et al. hanno poi esaminato molti modelli di previsione COVID-19 statunitensi per i decessi, i ricoveri ospedalieri e i ricoveri in terapia intensiva, evidenziando i margini estremamente ampi con cui non hanno raggiunto i loro obiettivi. Ioannidis et al. hanno proseguito:
“Nonostante questi evidenti fallimenti, la previsione delle epidemie [COVID-19] ha continuato a prosperare, forse perché le previsioni ampiamente errate sono tipicamente prive di gravi conseguenze… Una volta acquisite solide prove sulle caratteristiche epidemiologiche delle nuove epidemie, le previsioni esagerate e poco plausibili (Ioannidis, 2020d) dovrebbero essere abbandonate. Altrimenti, potrebbero causare più danni del virus stesso”.
[16] (p. 428)
Le narrazioni sociali, una volta radicate, diventano difficili da modificare.
Stime accurate delle vite salvate o perse grazie ai vaccini basati sul gene COVID-19 avrebbero richiesto studi a lungo termine su individui vaccinati rispetto a quelli non vaccinati. Pfizer, Moderna, AstraZeneca e Janssen alla fine hanno vaccinato quasi tutti i soggetti placebo, perdendo così il gruppo di controllo. Questa scelta si è basata su principi etici, data la paura del COVID-19 [17], ma la perdita dell’integrità scientifica derivante dall’avere solo studi a breve termine controllati con placebo è stata notata dal gruppo di esperti ad hoc dell’OMS sulle prossime fasi della valutazione del Covid-19 (2020) [18].
Per colmare questo deficit, un’organizzazione privata con sede nel Regno Unito, la Control Group Cooperative [19], ha raccolto dati dal lancio della vaccinazione COVID-19 ed è l’unico gruppo di controllo a livello mondiale.
Di questa coorte non vaccinata, 18.497 persone hanno partecipato a un’indagine che riportava i test positivi al COVID-19 e la gravità dei sintomi tra settembre 2021 e febbraio 2022. Un quarto (4636, 25,1%) ha riferito di aver avuto una malattia COVID-19 sintomatica. I sintomi sono stati indicati come “lievi” dal 14,4%, “moderati” dall’8,7% e “gravi” dal 2%. Altri 560 hanno riferito una malattia asintomatica e dei 5196 affetti da COVID-19, solo 74 (1,4%) hanno riferito di essere stati ricoverati in ospedale (come pazienti interni o esterni) e 21 (0,4%) sono stati ricoverati per più di una settimana. Essendo un’indagine autodichiarata, le limitazioni includono i decessi che potrebbero non essere stati segnalati; ciononostante, la coorte è andata meglio del previsto. Il gruppo è forse insolito in quanto il 71% ha assunto una combinazione di vitamine C, D, quercetina, zinco e ivermectina o idrossiclorochina off-label, se disponibili [20].
In questo contesto, i dati sanitari del governo dello Stato australiano (NSW) di novembre e dicembre 2022 [21] (Figura 1 e Figura 2) dimostrano che i non vaccinati non sono quasi rappresentati nei dati di ospedalizzazione, mentre i più vaccinati sono sovrarappresentati. La percentuale di non vaccinati nel NSW era bassa, pari al 3,2%; tuttavia, la percentuale di non vaccinati con COVID-19 grave è più bassa alla fine del 2022, con il 2,9%. Anche tenendo conto di un maggior numero di richiami del vaccino COVID-19 negli anziani e nei soggetti vulnerabili, i dati non suggeriscono un’efficacia significativa contro l’ospedalizzazione, il ricovero in terapia intensiva e la morte, almeno dopo la comparsa del ceppo Omicron.
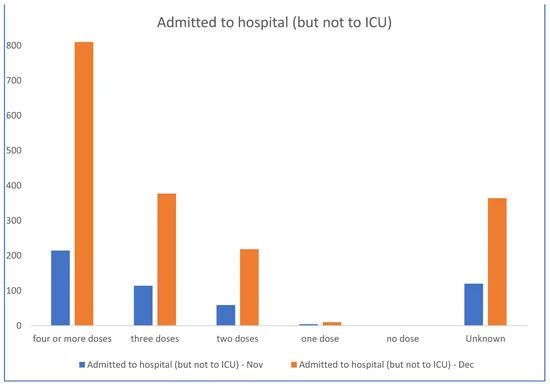
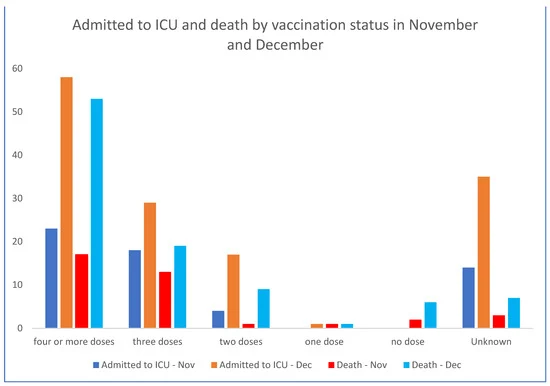
Figura 1. Ricoveri ospedalieri, ricoveri in terapia intensiva e decessi nelle ultime 6 settimane 2022 in Australia per stato vaccinale. NSW Health. Grafici a barre derivati dai numeri del rapporto ufficiale del governo, estratto dalla Figura 2 [21].
Per le settimane 51 e 52 del 2022, i dati del governo del NSW documentano zero ricoveri e sei decessi per le persone non vaccinate, ma 1415 ricoveri e 82 decessi nelle persone vaccinate note. La NSW Health non pubblica più lo stato di vaccinazione. Questi dati non supportano la premessa che le vaccinazioni abbiano “salvato milioni di vite”, ma indicano invece che le correlazioni tra un maggior numero di dosi e malattie gravi da COVID-19 meritano un’indagine. Si è registrato un aumento della mortalità per tutte le cause in concomitanza con l’introduzione dei vaccini basati sul gene COVID-19 e questo merita ulteriori ricerche.
I modelli matematici producono numeri altamente incerti che predicono il futuro. Queste previsioni possono essere politicizzate. Per assicurarsi che le previsioni non diventino un’appendice di una causa politica, i modellatori, i decisori e i cittadini devono stabilire i fatti reali che ci rendono tutti responsabili.
Se i vaccini COVID-19 sono meno efficaci di quanto inizialmente sperato e successivamente dichiarato, il processo decisionale sul rapporto rischio/beneficio per il consenso informato individuale e la politica di salute pubblica cambia. Il grado di danno causato dalla nuova tecnologia vaccinale basata sui geni potrebbe allora superare qualsiasi beneficio.
3. Corrispondenza tra il TGA e il senatore australiano Rennick
In Australia, la Therapeutic Goods Administration (TGA) ha approvato provvisoriamente i vaccini COVID-19 di Pfizer (Comirnaty, BNT162b2), Moderna (SPIKEVAX, mRNA-1273), AstraZeneca (Vaxzevria, ChAdOx1 nCOV-19) e Janssen (COVID-19 Vaccine, Ad26. COV2.S) all’inizio del 2021 [22] e nel gennaio 2022 è stato aggiunto il vaccino a base di lipidi e nanoparticelle di Novavax (Nuvaxovid, NVX-CoV2373) [23].
Il 16 dicembre 2022, il Dipartimento della Salute australiano, consigliato dal TGA, ha risposto all’interrogazione 235 del 21 novembre 2022 del senatore Gerard Rennick (Partito Liberale, Qld) nell’interrogazione della Commissione Affari Comunitari del Senato sull’avviso SQ22-000609. Il senatore Rennick, il cui ufficio parlamentare ha ricevuto numerose segnalazioni di lesioni da vaccino COVID-19 da parte di australiani, ha chiesto se il rapporto della stessa TGA [5], che mostrava alti tassi di trasfezione e di espressione ampiamente biodistribuiti dei vaccini a base di mRNA di COVID-19, fosse una prova che i vaccini erano più patogeni del virus, il che implicava un maggior carico di proteine spike sulle cellule umane [24].
Il TGA ha risposto:
“C’è un po’ di confusione in merito alla biochimica e all’immunologia. Un tasso di traduzione e di espressione più elevato non è associato alla patogenicità, ma indica piuttosto una migliore espressione dell’antigene (proteina spike). La proteina spike espressa non è un agente patogeno e non è infettiva. La proteina spike è solo uno dei componenti del coronavirus. Serve come antigene per indurre risposte immunitarie umorali e cellulari contro il virus SARS-CoV-2″.
[24]
Come autori australiani di questo documento, concordiamo con l’opinione del TGA secondo cui la proteina spike prodotta dai vaccini COVID-19 a base di geni agisce come antigene per indurre risposte immunitarie e non è un intero microrganismo patogeno. Tuttavia, la risposta del TGA non ha colto il punto della questione. Riassumeremo le prove che la stessa proteina spike è indipendentemente bioattiva e patogena. La proteina spike è stata direttamente correlata sia alla fisiopatologia alla base della malattia virale COVID-19 sia ai gravi eventi avversi causati dai vaccini COVID-19 che, attraverso meccanismi di terapia genica, inducono le cellule umane a produrre la proteina spike in numero considerevole.
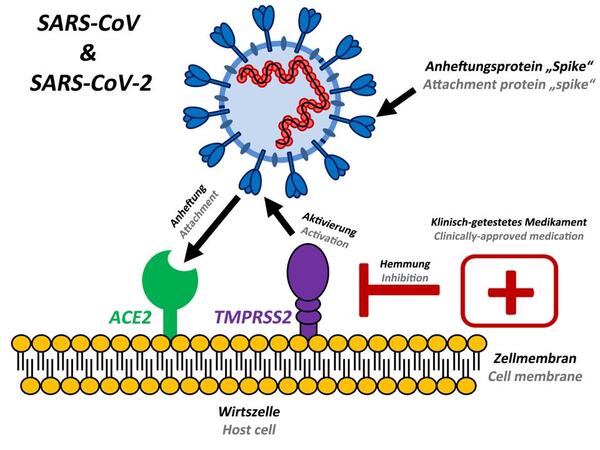
In effetti, la proteina spike nell’epidemia originale di SARS coronavirus 1 (SARS CoV-1) del 2003 è stata identificata come causa di lesioni polmonari per le quali è stato coniato il termine “sindrome respiratoria acuta grave” (SARS). Si pensava che agisse sui recettori dell’enzima di conversione dell’angiotensina 2 (ACE-2). La downregulation dei recettori dell’ACE-2 indotta dalla proteina spike del SARS-CoV-1 (virus 2003) ha provocato edema polmonare e insufficienza polmonare acuta nei topi, come pubblicato su Nature Medicine [25].
4. Metodologia della revisione narrativa
Presentiamo qui una revisione narrativa della letteratura che fornisce prove della tossicità e quindi della patogenicità della proteina spike, indipendentemente dal suo ruolo di determinante patogeno nell’infezione da SARS-CoV-2. Si tratta di proteina proveniente dal virus SARS-CoV-2 o prodotta da codice genetico in cellule umane direttamente da mRNA (Pfizer e Moderna) o da mRNA derivato dai vaccini COVID-19 con adenovettoreDNA (AstraZeneca e Janssen).
Vengono inoltre esaminate le evidenze di letteratura relative al profilo di tossicità e biodistribuzione delle matrici lipidiche-nanoparticelle per i vaccini COVID-19 a base di mRNA Moderna e Pfizer e a base di proteine Novavax; la natura modificata dell’mRNA sintetico che spiegherebbe la persistenza prolungata dell’mRNA e la produzione di picchi proteici; il fenomeno della variazione del “lotto difettoso” nelle segnalazioni di eventi avversi e le considerazioni sul rischio/beneficio per le vaccinazioni COVID-19, in particolare per le coorti pediatriche e di giovani adulti.
Questi aspetti farmacocinetici e farmacodinamici riguardano la patogenicità dei vaccini COVID-19 basati sul gene. Nel contesto della risposta del TGA di cui sopra, gli aspetti farmacocinetici e di biodistribuzione dei vaccini COVID-19 basati sul gene sono simili a un agente “infettivo”, in fase invasiva o ematica, in quanto distribuiscono gli effetti patogeni della proteina spike in tutto l’organismo.
Questa revisione presenta prove tratte dalla letteratura accademica, nonché documenti di farmacovigilanza e di sperimentazione clinica di Pfizer, tramite ordini di Freedom of Information (FOI), per aiutare il TGA e altri enti regolatori e autorità sanitarie a rivalutare la tossicità delle proteine spike prodotte da mRNA e adenovectorDNA. Sta emergendo una nuova era della patologia che potrebbe essere definita “spikeopatia”. È inoltre fondamentale valutare il potenziale di eventuali nuovi fenomeni autoimmuni guidati dalla produzione di antigeni estranei causati da qualsiasi nuova tecnologia basata su mRNA o DNA in futuro.
Le prove dei danni causati dalla “spikeopatia“, così come altre forme di danno fisiopatologico, sono esaminate per sistema d’organo, mentre una revisione dei dati di farmacovigilanza sarà oggetto di un ulteriore articolo.
I punti chiave riportati di seguito riassumono le informazioni presentate.
Punti chiave
I vaccini altamente sicuri ed efficaci sono fondamentali per combattere le epidemie/pandemie di malattie infettive.
La proteina spike del SARS-CoV-2 è patogena, sia che provenga dal virus sia che venga creata dal codice genetico nei vaccini a mRNA e adenovectorDNA.
I dati degli studi di biodistribuzione sui roditori mostrano che le nanoparticelle lipidiche trasportano l’mRNA in tutti gli organi e attraversano le barriere emato-encefaliche e emato-placentari. È probabile che alcuni di questi tessuti siano impermeabili all’infezione virale; pertanto, il rischio biologico è in particolare quello della vaccinazione.
Le nanoparticelle lipidiche hanno proprietà infiammatorie.
La modifica dell’mRNA con N1-metilpseudouridina per aumentarne la stabilità porta alla produzione di proteine spike per mesi. Non si sa quante cellule e da quali organi vengano prodotte le proteine spike di mRNA e quindi non si conosce l’esatta dose efficace somministrata per fiala di vaccino.
Il destino a lungo termine dell’mRNA all’interno delle cellule è attualmente sconosciuto.
I vaccini a base di mRNA e adenovettore-DNA agiscono come “virus sintetici”.
Nelle persone giovani e sane, e anche in molti individui anziani con comorbidità vulnerabili, i vaccini COVID-19 basati sulla codifica probabilmente trasfetteranno un insieme di tessuti molto più diversificato rispetto all’infezione da parte del virus stesso.
Le prove suggeriscono che è possibile la trascrizione inversa dell’mRNA in una copia di DNA. Ciò suggerisce inoltre la possibilità di una trasmissione intergenerazionale se le cellule germinali incorporano la copia del DNA nel genoma dell’ospite.
La produzione di proteine estranee, come la proteina spike sulla superficie delle cellule, può indurre risposte autoimmuni e danni ai tessuti. Ciò ha implicazioni profondamente negative per qualsiasi futuro farmaco o vaccino a base di mRNA.
La proteina spike esercita i suoi effetti fisiopatologici (“spikeopatia”) attraverso diversi meccanismi che portano all’infiammazione, alla trombogenesi e al danno tissutale legato all’endoteliosi e alla disregolazione legata ai prioni.
L’interazione della proteina spike codificata dal vaccino con ACE-2, P53 e BRCA1 suggerisce un’ampia gamma di possibili interferenze biologiche con potenziale oncologico.
I dati sugli eventi avversi provenienti dai database ufficiali di farmacovigilanza, un rapporto FDA-Pfizer ottenuto tramite FOI, mostrano tassi elevati e molteplici sistemi d’organo interessati: principalmente neurologico, cardiovascolare e riproduttivo.
I dati degli studi clinici sui vaccini COVID-19 a base di mRNA di Pfizer e Moderna, interpretati in modo indipendente, sono stati sottoposti a peer-review e pubblicati per mostrare un rischio/beneficio sfavorevole, soprattutto nei soggetti non anziani. I rischi per i bambini sono chiaramente superiori ai benefici.
Ripetute dosi di richiamo del vaccino COVID-19 sembrano indurre tolleranza e possono contribuire all’infezione ricorrente da COVID-19 e alla “COVID lunga”.
La pandemia di SARS-CoV-2 ha evidenziato le carenze delle agenzie di regolamentazione della salute pubblica e dei farmaci.
È necessaria un’analisi delle cause per quella che sembra una risposta affrettata a un’allarmante pandemia di malattie infettive.
Le modalità di trattamento della patologia correlata alla “spikeopathy” in molti sistemi di organi richiedono una ricerca urgente e la fornitura a milioni di persone che soffrono di lesioni da vaccino COVID-19 a lungo termine.
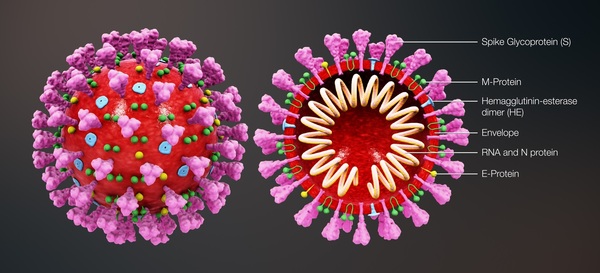
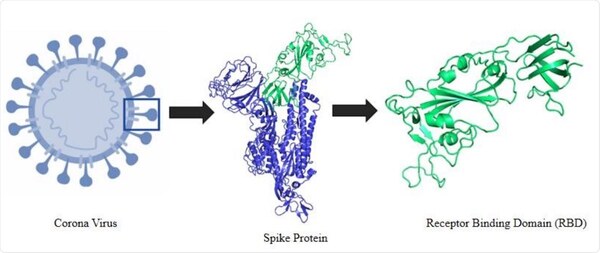
5. Struttura della proteina spike della SARS-CoV-2
La microscopia elettronica Cryo-EM ha rivelato la struttura della proteina spike all’inizio della pandemia [26]. Le proteine spike della SARS-CoV-2 sporgono all’esterno della parete cellulare del virus e sono in rosso nel diagramma schematico della Figura 3 di Cuffari [27].
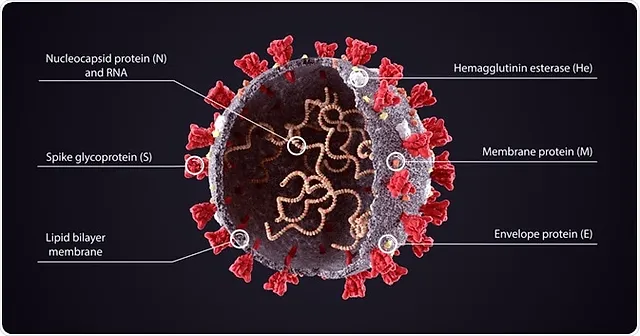
Figura 3. Schema delle varie proteine del virus SARS-CoV-2. Ristampato da News-Medical.net (accesso il 26 aprile 2023) Cuffari (2021): Cosa sono le proteine spike? (con permesso, licenza di Shuttercock). [27].
Nel contesto dell’infezione da SARS-CoV-2, la proteina spike è un determinante patogeno dell’invasione cellulare, costituito da due subunità: S1, all’estremità distale della glicoproteina spike che punta verso l’esterno del virus, costituita da un dominio N-terminale (NTD) e da un trimero di tre domini leganti i recettori (RBD), e S2, costituita principalmente da una regione C-terminale che forma il peduncolo della proteina spike e si incastra prossimalmente nell’involucro o nella membrana del virus.
Il virus utilizza la proteina spike per legarsi ai recettori ACE-2 presenti sulle superfici cellulari ed entrare nelle cellule. A tal fine, il dominio di legame con il recettore (RBD) della subunità S1 subisce un’estensione simile a una cerniera dalla posizione “in basso” a quella “in alto” per interagire con il recettore ACE-2.
La Figura 4, tratta da Wrapp et al. [26], mostra uno dei tre RBD ‘trimer’ in verde in posizione ‘up’, mentre gli altri due RBD sono ‘down’ e inaccessibili all’attacco con ACE-2. Il diagramma a sinistra è la vista della proteina spike di profilo e a destra è una vista della subunità S1 o della parte superiore della proteina spike trimerica dall’alto.
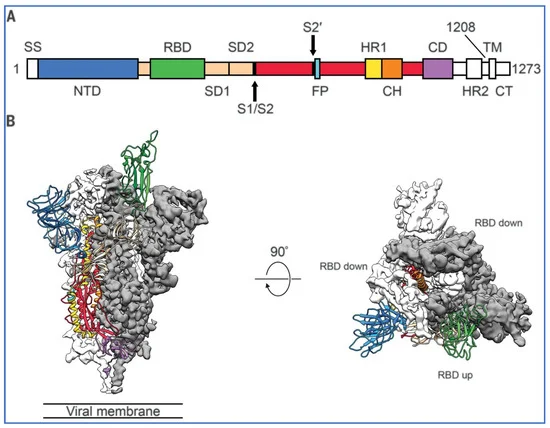
Figura 4. Struttura di 2019-nCoV S nella conformazione di prefusione. (A) Schema della struttura primaria di 2019-nCoV S colorato per dominio. I domini esclusi dal costrutto di espressione dell’ectodominio o che non è stato possibile visualizzare nella mappa finale sono colorati in bianco. SS, sequenza segnale; S2′, sito di clivaggio della proteasi S2′; FP, peptide di fusione; HR1, heptad repeat 1; CH, elica centrale; CD, dominio connettore; HR2, heptad repeat 2; TM, dominio transmembrana; CT, coda citoplasmatica. Le frecce indicano i siti di clivaggio delle proteasi. (B) Vista laterale e superiore della struttura di prefusione della proteina 2019-nCoV S con un singolo RBD nella conformazione up. I due protomeri RBD down sono mostrati come densità crio-EM in bianco o grigio e il protomero RBD up è mostrato in nastri colorati corrispondenti allo schema in (A). Ristampato da [26] Figura 1, Copyright (2022) con autorizzazione.
5.1. La proteina Spike prodotta dal vaccino ha RBD protettive chiuse?
Il virione del SARS-CoV-2 trasporta la proteina spike sotto forma di trimeri, prevalentemente in forma di prefusione. I trimeri della proteina spike in prefusione si trovano in varie conformazioni, sia chiuse, con tutte e tre le RBD distese sulla sommità della spike, sia aperte, in cui una o più RBD sporgono dalla sommità della spike. Il sito di legame del recettore (RBS) è in gran parte inaccessibile quando le RBD sono in posizione abbassata. La proteina Spike contiene un sito di clivaggio della furina, dove può essere scissa nelle subunità S1 e S2, il che facilita l’infettività. La serina proteasi è necessaria per scindere la proteina spike nelle subunità S1 e S2, il che aumenta notevolmente l’infettività attraverso il recettore ACE-2.
Dopo l’interazione con il recettore, la proteina spike subisce un riarrangiamento conformazionale che porta all’esposizione della subunità S2, all’inserimento del peptide di fusione nella membrana della cellula bersaglio e al ripiegamento di S2.
Questo ripiegamento fa convergere il peptide di fusione e il dominio transmembrana della proteina spike, avvicinando le membrane della cellula bersaglio e del virus e provocandone la fusione. Per analogia, immaginate un apribottiglie che tira su il tappo dal collo della bottiglia, ma il tappo è collegato a una membrana cellulare che viene tirata su insieme a lui [28].
I vaccini disponibili in commercio in Australia si basano su mutazioni ingegnerizzate nella proteina spike, progettate per stabilizzare lo stato di prefusione e ridurre la transizione alla forma post-fusionale, limitando così il clivaggio. Le mutazioni includono la sostituzione di due residui con una doppia prolina (ad esempio, Pfizer/BioNTech, Moderna, Novavax e Janssen) o mutazioni nel sito di clivaggio della furina per la resistenza alle proteasi (Janssen).
Alla luce dei dati raccolti, che suggeriscono che l’mRNA e le proteine spike create da adenovettoriDNA causano danni, queste salvaguardie teoriche sembrano essere fallite.
Le ragioni del fallimento di questo sistema possono essere molteplici. Poiché solo l’mRNA, e non la proteina spike completa, viene iniettato con le nanoparticelle lipidiche, esiste la possibilità che i frammenti di mRNA non siano completi, a causa di una sintesi non ottimale o della degradazione dopo la produzione. La proteina spike potrebbe quindi essere parzialmente espressa come proteina spike tronca con una conformazione che consente il clivaggio in una parte peptidica e in una subunità funzionale S1 o S2.
Anche con l’espressione di un codice proteico completo, una parte del clivaggio può avvenire all’interno delle cellule. Nessun sistema biologico è efficace al 100% e la mutazione dovrebbe solo ridurre, non impedire completamente, la scissione in S1 e S2. Il trasporto di proteine o subunità spike attraverso esosomi, fusione cellulare diretta e tunnel nanotubolari verso altre cellule è ancora possibile. Errori di espressione all’interno della cellula potrebbero far sì che le proteine spike mantengano alcune funzioni. La contaminazione con vettori plasmidici in grado di replicarsi lascia la possibilità di mutazioni durante la replicazione o l’inserimento nel genoma.
La proteina spike non è solo tossica attraverso il legame con i recettori ACE-2, ma ha anche effetti citotossici all’interno delle cellule attraverso l’interazione con i geni soppressori del cancro BRCA e P53 e danni mitocondriali, coagulopatie attraverso il contatto diretto con le proteine cellulari ed è neurotossica attraverso l’accumulo, con la diffusione e la riconfigurazione delle proteine prioniche nella loro forma patologica. L’accumulo della proteina spike all’interno delle cellule potrebbe avere effetti tossici e apoptotici [29].
5.2. Dominio simile alla tossina nella RBD
Recentemente è stato dimostrato un altro meccanismo di patogenicità. È stato dimostrato che la proteina spike contiene anche un dominio “simile a una tossina” nella RBD su S1, con un’omologia di sequenza con le glicoproteine del virus della rabbia (RBG) e dell’HIV e con la neurotossina NL-1, che si legano tutte ai recettori α7 dell’acido nicotinico dell’acetilcolina (α7 nAChR) del sistema colinergico [30]. La neurotossina NL-1 è una neurotossina, un tipo di veleno di serpente, simile all’archetipo della bungarotossina, un noto inibitore dell’α7 nAChR, con elevata affinità di legame. Le neurotossine a tre dita del veleno di serpente (α-3FNTx) agiscono sui recettori nicotinici postsinaptici dell’acetilcolina (nAChR) alla giunzione neuromuscolare (NMJ) per produrre paralisi del muscolo scheletrico e su specifici nACHR in altri siti [31], con conseguenti disturbi nel controllo dell’infiammazione [32].
Questo dominio di legame simile alla tossina di punta è una parte della RBD, adiacente al sito di legame del recettore ACE ed è stato dimostrato sia in uno studio simulato al computer [32] sia in studi elettrofisiologici, di legarsi preferenzialmente al nAChR α7 in dosi nanomolari, in modo simile alle neurotossine, come la bungarotossina. Il peptide attivo SCoV2P potenzia e inibisce le risposte del nAChR α7 indotte dall’acetilcolina (ACh) con un potenziale meccanismo allosterico a potenze nanomolari e la nicotina potenzia questi effetti. A basse dosi, potenzia e a dosi più elevate inibisce la funzione dei nAChR [33].
Questo modello di legame potrebbe fornire spiegazioni logiche per il disturbo infiammatorio acuto e altre condizioni nei pazienti con COVID-19, COVID lunga e lesioni da vaccinazione, che possono essere collegate a una grave disregolazione del sistema nervoso centrale.
6. Motivi di preoccupazione: Farmacodinamica, farmacocinetica e fisiopatologia
I dati farmacocinetici e farmacodinamici sono fonte di preoccupazione per il design concettuale dei vaccini COVID-19 a mRNA e adenovettore-DNA e pongono le basi per la comprensione della fisiopatologia che viene ora ampiamente riportata. La biodistribuzione non è controllata, così come la durata e la biodisponibilità persistente della proteina spike.
6.1. I vaccini basati sui geni sono una nuova tecnologia sperimentale
Il numero senza precedenti di eventi avversi sembra essere associato alle proteine spike prodotte dalle tecnologie basate sui geni impiegate da Pfizer, Moderna, AstraZeneca e Johnson and Johnson. La tecnologia Viral-VectorDNA è impiegata anche nei vaccini Sputnik V e EpiVacCorona COVID-19 in Russia, iNCOVACC in India e Convidecia in Cina. Tuttavia, la maggior parte dei vaccini COVID-19, prodotti per lo più in Paesi non occidentali, sono vaccini tradizionali a base di proteine o di virus inattivati non genetici [34,35].
I vaccini COVID-19 a base di geni rientrano in una classe speciale di agenti terapeutici definiti dalla FDA come “prodotti di terapia genica” [36], in quanto le cellule riceventi producono antigeni per l’espressione transmembrana o per lasciare la cellula, per invocare secondariamente una risposta immunitaria. Pertanto, grazie all’invasione virale e al dirottamento della trascrizione cellulare, sia i vaccini a base di mRNA che di geni adenovettoriali a DNA fanno sì che le cellule non immuni diventino di fatto cellule presentanti l’antigene, nella loro modalità di immunogenicità. Pertanto, queste nuove piattaforme vaccinali rischiano di provocare danni tissutali secondari a risposte autoimmuni citopatiche, sollevate contro le cellule che esprimono antigeni di spike estranei.
Prima della pandemia di SARS-CoV-2, l’uso di questa tecnologia era sperimentale e per lo più limitato alla produzione di proteine per la terapia del cancro metastatico. Nessun vaccino a mRNA era mai stato autorizzato per l’uso pubblico prima della pandemia di COVID-19 [37] e i vaccini a DNA-vettore virale avevano avuto un uso limitato per Ebola, Dengue ed encefalite giapponese [38].
I documenti ottenuti con una richiesta di Freedom of Information (FOI) rivelano che i vaccini COVID-19 a base di mRNA sono stati sviluppati attraverso il programma “Operation Warp Speed” dell’amministrazione Trump, sotto l’egida del Dipartimento della Difesa statunitense. I vaccini di tecnologia genetica erano “contromisure” di emergenza per una minaccia alla sicurezza nazionale, che probabilmente all’inizio sembrava essere la pandemia del 2020. In quanto tali, molti dei normali protocolli di test di sicurezza e tossicologici della FDA, lunghi e dispendiosi in termini di tempo, sono stati aggirati nella fretta di ottenere lo status di autorizzazione all’uso di emergenza [39,40,41].
6.2. Ampia distribuzione della nanoparticella lipidica
Turni e Lefringhausen [42], in “COVID-19 vaccines-An Australian Review”, osservano che la nanoparticella lipidica, il vettore dell’mRNA sintetico, è potenzialmente infiammabile di per sé, attraversa le membrane e si distribuisce ampiamente nell’organismo. Attraversa sia la barriera emato-encefalica che quella emato-placentare. Citano il rapporto dell’EMA sul vaccino Moderna “secondo cui l’mRNA potrebbe essere rilevato nel cervello dopo la somministrazione intramuscolare a circa il 2% del livello trovato nel plasma” (p. 491). Citano anche ricerche [43,44,45] che descrivono come e perché le nanoparticelle lipidiche attraversano facilmente la barriera emato-encefalica.
Il Prof. Byram Bridle, virologo-vaccinologo canadese, ha ottenuto i dati di biodistribuzione degli studi sui roditori di Pfizer dalla Pharmaceuticals and Medical Devices Agency (PMDA) giapponese tramite una richiesta FOI nel 2021 [46]. Judicial Watch, una fondazione di vigilanza indipendente statunitense, ha ottenuto lo stesso rapporto dello studio Pfizer tramite una causa FOI al Dipartimento della Salute e dei Servizi Umani degli Stati Uniti, dopo che la FDA e il CDC si erano rifiutati di ottemperare [47]. Una più recente richiesta FOI al TGA australiano (risposta FOI 2389-6) rivela che a pagina 45 del “rapporto di valutazione non clinica” del TGA: BNT162b2 COVID-19 vaccine” che lo stesso studio faceva parte della valutazione del TGA nel gennaio 2021 prima dell’autorizzazione provvisoria [5] (pag. 45).
Lo studio di biodistribuzione di Pfizer ha coinvolto 63 ratti Wistar Han, di cui 42 (21 maschi, 21 femmine) sono stati iniettati con l’equivalente umano di 50 µg di mRNA per animale, e altri 21 ratti maschi sono stati iniettati con l’equivalente di una dose di vaccino Moderna COVID-19 di 100 µg di mRNA per animale. L’mRNA che codifica per la luciferasi è stato incapsulato in nanoparticelle liquide contenenti colesterolo radiomarcato, iniettato nel muscolo gluteo e monitorato per 48 ore. Come indicato nella Figura 5, i dati di biodistribuzione hanno mostrato che le nanoparticelle lipidiche, progettate per passare facilmente attraverso i tessuti e le membrane biologiche, hanno raggiunto tutti gli organi. Entro 48 ore, il 75% aveva lasciato il sito di iniezione per andare altrove [5,47].
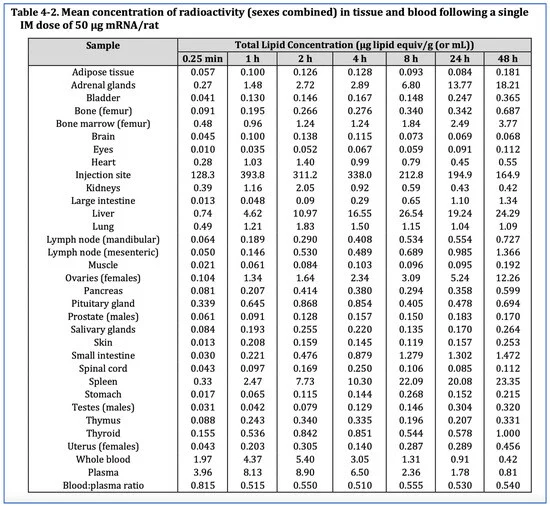
Figura 5. Biodistribuzione di nanoparticelle lipidiche nel ratto, studio Pfizer novembre 2020. Dalla risposta TGA FOI 2389-6 [5] (pag. 45).
Sebbene i livelli più elevati siano stati riscontrati nella milza e nel fegato, dove l’elevato ricambio cellulare favorisce la riparazione tempestiva di eventuali danni citotossici, la nanoparticella lipidica, e di conseguenza l’mRNA, è arrivata apparentemente in tutti gli organi, in particolare nelle ovaie e nelle ghiandole surrenali, ma anche nel cervello, negli occhi, nel cuore, nei testicoli, nell’utero, nell’ipofisi, nel midollo spinale, nel timo e nel midollo osseo.
Lo studio di Pfizer sulla biodistribuzione nei topi è stato confermato. Ricercatori cinesi hanno iniettato nei topi complessi lipido-nanoparticelle-mRNA (mRNA-LNP) codificanti il gene della luciferasi di lucciola e la biodistribuzione dal sito di iniezione “si è distribuita rapidamente in tutto il corpo con una grande presenza nel fegato” e la “relazione non lineare tra l’esposizione all’LNP e il livello di espressione della proteina varia nei diversi tessuti e organi” [48] (p. 114). Complessi mRNA-LNP più piccoli trasfettati ulteriormente e quantità relativamente minori di mRNA nel fegato e nei linfonodi hanno prodotto tassi più elevati di proteine bioluminescenti codificate rispetto al muscolo del sito di iniezione. Gli autori hanno dichiarato che:
“La durata e la cinetica dell’espressione del transgene sono influenzate dalla farmacocinetica e dalla biodistribuzione dei sistemi di rilascio. La relazione farmacocinetica-farmacodinamica degli mRNA-LNP è molto complessa, rendendo improbabile la previsione dell’espressione genica e dell’efficacia (farmacodinamica) solo in base all’esposizione degli LNP nei tessuti (farmacocinetica)”.
[46] (pp. 112-113)
In effetti la nanoparticella lipidica, e presumibilmente il suo carico di mRNA, si distribuisce in tutto il corpo e l’espressione genica varia in modo imprevedibile [5,46,48].
6.3. L’mRNA pseudouridinico di lunga durata
L’RNA messaggero naturale è altamente instabile, pertanto l’mRNA sintetico che codifica per la proteina spike nei vaccini Moderna e Pfizer COVID-19 è stato stabilizzato mediante la sostituzione dell’uridina con N1-metilpseudouridina [37]. È noto che questo intervento rende l’mRNA sintetico eccessivamente stabile per un periodo prolungato [49]. Fertig et al. [50] hanno riscontrato che la nanoparticella lipidica e l’mRNA contenuto erano ancora in circolazione nel plasma sanguigno 15 giorni dopo la vaccinazione. Una recente ricerca ha trovato l’mRNA nel plasma sanguigno a 28 giorni dalla vaccinazione [51]. Inoltre, la subunità S1 è stata trovata in circolo in quantità picomolari insieme alla proteina spike completa in uno studio del Brigham and Women’s Hospital su 13 infermiere vaccinate con il vaccino Moderna COVID-19 mRNA a circa 42-72 h [52].
Röltgen et al. [53] hanno riscontrato la persistenza per tutti i 60 giorni del loro studio sia dell’mRNA che delle proteine spike libere nel citoplasma e nei nuclei delle cellule germinali nei linfonodi ascellari omolaterali al sito di iniezione del muscolo deltoide. Le proteine spike persistevano nel sangue del 96% dei vaccinati fino a 2 giorni dopo la vaccinazione ed erano ancora presenti nel 63% dei vaccinati una settimana dopo la prima dose. Dopo la seconda dose, la rilevazione della proteina spike “è ostacolata … probabilmente a causa … degli anticorpi anti-spike” (p. 1037). Tuttavia, come mostrato in precedenza, le molecole di RNA modificate sono straordinariamente stabili e, finché persistono all’interno della cellula e questa non viene attaccata e uccisa dal sistema immunitario, la produzione intracellulare di proteine ribosomiali spike persisterà. Nessuno studio ha determinato la stabilità della proteina spike indotta dal vaccino, ma la proteina spike libera è stata trovata in circolazione fino a 19 giorni dopo la vaccinazione nel plasma di giovani individui con miocardite post-vaccino [54].
Le implicazioni dei risultati di Röltgen et al. [53] sono state elaborate in dettaglio in un blogpost di Jikomes [55] come indicative di pericolo, mentre un blogpost di Yong [56] sostiene che la presenza prolungata di mRNA e proteine spike non è pericolosa. Tuttavia, Yong ammette che la persistenza era inaspettata. Le autorità sanitarie avevano assicurato ai medici e al pubblico, all’inizio dell’introduzione del vaccino COVID-19, che la persistenza della produzione di proteine spike mRNA sarebbe stata breve e localizzata al deltoide. Questo non è chiaramente il caso e le implicazioni biologiche della traduzione persistente della proteina spike in più tipi di tessuto meritano di essere studiate.
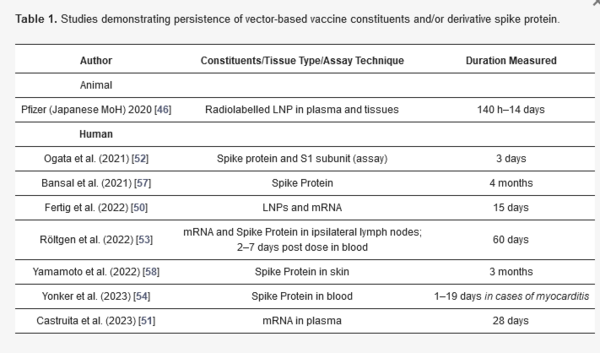
I risultati di questi studi sono coerenti con l’emivita di 14 giorni dell’mRNA-LNP nello studio di biodistribuzione sui ratti del Ministero della Salute giapponese Pfizer [46] e sono riassunti nella Tabella 1.
Tabella 1. Studi che dimostrano la persistenza dei costituenti del vaccino basato sul vettore e/o della proteina spike derivata.
Le cellule che assorbono l’mRNA dai vaccini a mRNA impacchettano parte dell’mRNA con lipidi cationici ionizzabili in piccole particelle lipidiche che vengono rilasciate come esosomi [59]. Altre ricerche hanno rilevato che le proteine spike persistono negli esosomi circolanti per almeno quattro mesi dopo la vaccinazione con Pfizer COVID-19 [57]. Ciò dimostra che la resistenza delle proteine spike, come quella dell’mRNA, è di lunga durata in vivo. La riattivazione del virus della varicella zoster (VZV) come herpes zoster è l’evento avverso cutaneo più comune dopo la vaccinazione con mRNA COVID-19 ed è stato riportato un caso in cui la proteina spike è stata rilevata nelle lesioni cutanee 3 mesi dopo la vaccinazione [58]. Questi autori hanno ipotizzato che:
“la vaccinazione con mRNA COVID-19 potrebbe indurre una riattivazione persistente del VZV attraverso la perturbazione del sistema immunitario, anche se rimane sfuggente se la proteina spike espressa abbia un ruolo patogeno”.
[58]
Gli autori ipotizzano diversi modi in cui i vaccini COVID-19 possono perturbare il sistema immunitario: attraverso le nanoparticelle lipidiche, la N1-metilpseudouridina nell’mRNA, la proteina spike (in particolare la subunità S1), il potenziamento anticorpo-dipendente e uno stimolo antigenico eccessivo [58]. La nostra revisione di un’ampia e crescente letteratura rivela che queste preoccupazioni hanno una base probatoria e che esiste un ruolo patogeno per la proteina spike.
6.4. Tossicologia delle nanoparticelle
Wang et al. hanno dimostrato nel 2018 che anche piccole quantità di nanoparticelle assunte attraverso i polmoni o la pelle possono provocare effetti citotossici [60]. Quando vengono ingerite, le nanoparticelle colpiscono prevalentemente i linfonodi mesenterici, il fegato e la milza, mentre quando vengono iniettate come vettore di farmaci, possono superare qualsiasi barriera e traslocare al cervello, alle ovaie e ai testicoli, soprattutto dopo la fagocitosi da parte dei macrofagi che contribuiscono a distribuirle nell’organismo. Gli effetti della tossicità riproduttiva esulano dall’ambito di questa rassegna.
I meccanismi molecolari coinvolti nella tossicità delle nanoparticelle sul sistema riproduttivo non sono del tutto noti, ma i possibili meccanismi includono lo stress ossidativo, l’apoptosi, l’infiammazione e la genotossicità attraverso l’induzione di specie reattive dell’ossigeno (ROS), che causano danni a livello molecolare e genetico con conseguente citotossicità e danno al DNA.
Particolarmente preoccupanti nei complessi mRNA-LNP sono i due eccipienti funzionali proprietari, ALC-0315 e ALC-0159, mai utilizzati prima in un medicinale e non registrati né nella Farmacopea europea né nell’inventario europeo C&L [61]. Un’interrogazione del Parlamento europeo del dicembre 2021 ha rilevato che “Echelon, il produttore di queste nanoparticelle, specifica che sono ‘solo per la ricerca e non per uso umano’”. La risposta a nome della Commissione europea è stata che l’eccipiente “in Comirnaty è stato dimostrato essere appropriato … in conformità con le linee guida e gli standard scientifici pertinenti dell’EMA” [62]. Nonostante questa rassicurazione, la presenza di elettroliti nella preparazione e la diluizione manuale prima dell’inoculazione sollevano seri interrogativi sulla stabilità della sospensione risultante e sull’indice di polidispersità dei nanomateriali in essa contenuti, fattori che possono essere ipotizzati come cause principali di numerosi effetti avversi post-vaccinazione.
Una nanoparticella in soluzione forma un sistema colloidale la cui stabilità impedisce l’aggregazione delle particelle attraverso la repulsione elettrostatica. Il parametro utilizzato per calcolare la stabilità colloidale è il potenziale Zeta, che si riferisce al potenziale generato da un doppio strato di cariche elettriche. Quando il potenziale è basso, le forze attrattive prevalgono su quelle repulsive e si formano più aggregati. La stabilità di un sistema colloidale bifasico è un equilibrio precario che dipende dai rapporti, dai metodi di lavorazione, dalle temperature corrette e dalla presenza di elettroliti [63]. Dopo la diluizione con una soluzione di cloruro di sodio, il rapporto finale in Comirnaty è di 2,61 mg di elettroliti contro solo 0,48 mg di ALC-0315 + ALC-0159. Questo non può che portare a una drastica riduzione del potenziale Zeta, con prevedibile aggregazione, agglomerazione e, infine, flocculazione. Si può ipotizzare il danno causato dall’aggregazione delle nanoparticelle nei capillari di tutto il corpo.

Se la sospensione colloidale rimane abbastanza stabile da disperdersi nella linfa e nel sangue, le nanoparticelle e il loro carico tossico si distribuiscono nell’organismo, attraversano le barriere emato-encefaliche, emato-placentari e altre barriere biologiche e probabilmente causano morte cellulare e infiammazione ovunque si accumulino. Inoltre, l’eliminazione delle nanoparticelle tossiche dall’organismo non è semplice. Le particelle di 5,5 nm o meno possono essere espulse dopo la filtrazione glomerulare nei reni attraverso le vie urinarie. Le particelle più grandi potrebbero in teoria essere scomposte attraverso il tratto epatobiliare, ma tendono a essere legate, ad esempio, dalle cellule di Kupffer, i macrofagi residenti, che ne rallentano notevolmente l’elaborazione [64]. I complessi mRNA-LNP hanno una dimensione di circa 100 nm, ben superiore a quella che ne consente l’eliminazione attraverso i reni. Questo spiegherebbe il loro accumulo nel fegato e la tossicità epatica osservata.
6.5. Le nanoparticelle lipidiche sono pro-infiammatorie
È stato riscontrato che le nanoparticelle lipidiche utilizzate nei vaccini COVID-19 inducono una significativa secrezione di citochine infiammatorie e proteine infiammatorie dei macrofagi con morte cellulare [43]. Ndeupen et al. [43] notano che questo effetto pro-infiammatorio delle nanoparticelle lipidiche aumenterebbe l’immunogenicità del vaccino adiuvante dei vaccini a mRNA COVID-19 e si aggiungerebbe agli eventi avversi. Gli autori non hanno considerato l’ampia biodistribuzione della nanoparticella lipidica e quindi il potenziale di gravi effetti avversi del vaccino COVID-19 a livello di organi e sistemi.
Trougakis et al. [65], riesaminando la letteratura sugli eventi avversi dei vaccini a mRNA COVID-19, hanno rilevato il rischio di patologia guidata dalla proteina spike, che hanno definito “ipotesi spike”. Tuttavia, Trougakis e colleghi hanno anche esaminato l’evidenza delle proprietà pro-infiammatorie delle nanoparticelle lipidiche, ricavate da studi su modelli animali. Queste includono “l’attivazione dei recettori Toll-like, l’infiltrazione eccessiva di neutrofili, l’attivazione di diverse vie infiammatorie e la produzione di varie citochine e chemochine infiammatorie” [65] (pag. 544).
Pertanto, anche se si modificasse l’antigene espresso, probabilmente si verificherebbero comunque eventi avversi. Halma et al. [66] sottolineano le modifiche apportate all’mRNA e agli ingredienti delle nanoparticelle lipidiche, in particolare l’aggiunta di polietilenglicole (PEG), che le hanno rese più resistenti alla degradazione e le hanno aiutate a eludere il sistema immunitario, favorendo la biodistribuzione e il bioaccumulo delle nanoparticelle lipidiche. Il bioaccumulo può portare all’ostruzione dei piccoli vasi sanguigni e linfatici. La biodistribuzione significa che la morte cellulare e l’infiammazione potrebbero verificarsi in tutti gli organi, compresi il cervello, la placenta e i testicoli, come si è visto con il vaccino COVID-19 mRNA [5,44,45,46].
È noto che il PEG può causare reazioni anafilattiche in alcune persone, e questo è indicato come un evento avverso noto nel foglietto illustrativo del vaccino. Oltre al fatto che l’mRNA incapsulato in nanoparticelle lipidiche è altamente infiammatorio, gli anticorpi contro la proteina spike danneggiano le cellule e i tessuti che producono la proteina spike. Indipendentemente dall’antigene prodotto, in una reazione autoimmune si verifica un danno alle cellule [67].
I meccanismi coinvolti nel danno autoimmune alle cellule che producono una proteina endogena includono lo sviluppo di reattività crociata verso la proteina endogena [68], la tossicità immuno-mediata [69] e la tolleranza immunitaria dovuta al passaggio alle IgG4 [70]. Il passaggio a una risposta immunitaria IgG4 ha conseguenze sulla suscettibilità al cancro [71], sulla gravidanza [72] e sulle malattie legate alle IgG4, che sono condizioni infiammatorie croniche [73].
Un altro rischio, problematico con i precedenti vaccini contro i coronavirus sia in campo umano che veterinario, è il rischio di potenziamento anticorpo-dipendente [66].
6.6. Tossicità del vaccino Novavax COVID-19 e nuova tecnologia delle nanoparticelle lipidiche.
Il fatto che la biodistribuzione delle lipidi-nanoparticelle contribuisca in modo significativo agli eventi avversi è ulteriormente suggerito dalle segnalazioni di eventi avversi del vaccino Novavax COVID-19 a base di proteine Nuvaxovid. Il vaccino ha la tecnologia innovativa di una matrice lipidica-nanoparticellare che potrebbe potenzialmente aumentare la biodistribuzione della proteina spike immodificata, con i siti di scissione della furina e di legame con il recettore intatti. In risposta a una domanda sugli studi di biodistribuzione, Novavax ha risposto a metà del 2021 che “non è stato eseguito uno studio farmacocinetico/farmacodinamico sul vaccino Novavax COVID-19” (comunicazione personale Novavax-Parry, 30 luglio 2021).
Eventi avversi di miocardite sono stati segnalati per il vaccino Novavax COVID-19 in diversi Paesi, tra cui la Nuova Zelanda, dove l’ente regolatorio ha pubblicato una “Comunicazione di allerta” sulla miocardite [74]. Ciò suggerisce che una quantità patogena di proteine spike del vaccino Novavax COVID-19 può occasionalmente raggiungere il cuore. Nel complesso, le segnalazioni di eventi avversi del vaccino Novavax COVID-19 sono inferiori a quelle dei vaccini basati sui geni, il che sarebbe coerente con un effetto dose-risposta per le proteine spike. Tuttavia, la matrice lipido-nanoparticellare stessa potrebbe essere responsabile di alcune segnalazioni di miocardite.
6.7. Dati sulla biodistribuzione del vaccino COVID-19 di AstraZeneca
Nell’ottobre 2022 una richiesta FOI (MHRA IR07151D) ha ottenuto i documenti di AstraZeneca presentati all’MHRA britannico. Secondo la “Nonclinical Overview” di AstraZeneca del 21 dicembre 2020, il motivo per cui inizialmente non sono stati eseguiti studi di biodistribuzione sul vaccino adenovirusDNA COVID-19 di AstraZeneca è che studi precedenti su vaccini vettoriali virali hanno mostrato una diffusione minima dal muscolo deltoide e dai linfonodi ascellari agli organi distali [75]:
“Si prevede che la biodistribuzione di AZD1222 in seguito a somministrazione intramuscolare sia simile a quella di AdCh63, limitata al sito di iniezione e ai linfonodi drenanti”.
[75] (p. 13)
Tuttavia, un successivo “Nonclinical Overview” di AstraZeneca del 26 aprile 2021, che includeva nuovi studi di biodistribuzione sui topi del vaccino COVID-19 dell’azienda, ha rivelato una biodistribuzione agli organi distali [6]:
“I livelli più elevati di DNA del vettore AZD1222 (da 103 a 107 copie/µg di DNA) sono stati osservati nei siti di somministrazione intramuscolare e nel nervo sciatico (nelle immediate vicinanze dei siti di somministrazione) il 2° giorno. Livelli più bassi di DNA del vettore AZD1222 (da [6] (p. 14)
Il documento sottolinea che il vettore virale in sé non si stava replicando come un adenovirus, ma non è questo il punto della produzione proteica di un antigene estraneo tossico negli organi corporei. Sebbene ciò suggerisca che quantità minori di vaccini COVID-19 con vettore virale-DNA siano ampiamente biodistribuite rispetto ai vaccini COVID-19 con mRNA modificato trasportato da nanoparticelle lipidiche, rimane la capacità dei vaccini con adenovettore-DNA di produrre quantità significative di proteine spike. Una serie di autopsie di tre casi di trombocitopenia immune indotta da vaccino (VITT) con trombosi cerebrale correlata al vaccino COVID-19 di AstraZeneca ha trovato proteine spike nella trombosi e nelle pareti delle vene cerebrali [7]. Gli autori affermano nell’abstract che:
“Le proteine spike del SARS-CoV-2 sono state rilevate all’interno del trombo e nella parete del vaso adiacente. I dati indicano che i neutrofili e l’attivazione del complemento associata all’immunità antispike innescata dal vaccino sono probabilmente coinvolti nel processo della malattia”.
6.8. I vaccini COVID-19 tradizionali non contribuiscono alle segnalazioni di eventi avversi elevati
I vaccini COVID-19 tradizionali sono disponibili soprattutto nei Paesi non occidentali [35]. Si tratta di tecnologie vaccinali a virus inattivato come Covaxin prodotto da Bharat Biotech [76] in India e CoronaVac prodotto da Sinovac [77] in Cina.

Esistono anche vaccini COVID-19 tradizionali a base di proteine ricombinanti, come lo Spikogen, sviluppato congiuntamente da aziende australiane e iraniane [78,79,80]. Nello Spikogen l’antigene della proteina spike è stato modificato con la rimozione del sito di clivaggio della furina e della RBD per ridurre l’adesione e l’ingresso delle cellule e quindi per ridurre la potenziale tossicità. Uno studio clinico di fase 3 su Spikogen in Iran, che ha coinvolto 16.876 partecipanti, ha raggiunto l’endpoint primario di efficacia con una protezione superiore al 60% contro l’infezione durante un’ondata particolarmente diffusa in Iran della variante delta del SARS-CoV-2 [81,82]. Lo Spikogen è in commercio in Iran e riconosciuto per i viaggi in alcuni Paesi, tra cui la Nuova Zelanda, ed è stato utilizzato per 8 milioni di dosi senza alcuna segnalazione di eventi avversi sistemici gravi alla farmacovigilanza iraniana.
I vaccini COVID-19 tradizionali non hanno prodotto gli alti tassi di segnalazioni di eventi avversi che caratterizzano i vaccini COVID-19 a base di geni. Questa è un’ulteriore prova che il rischio risiede nella biodistribuzione a livello corporeo e nella produzione prolungata di proteine spike. Ciò indica la patogenicità della proteina spike e, alla luce delle prove sopra descritte, anche della matrice portante lipido-nanoparticellare.
6.9. Rischio autoimmune di antigeni estranei presentati da cellule proprie dell’organismo
Come descritto in precedenza, le prove dimostrano che la proteina spike è innatamente tossica. Anche se non fosse tossica di per sé, in virtù della sua estraneità, la proteina spike potrebbe comunque produrre danni fisiopatologici attraverso risposte autoimmuni. Una conseguenza diretta di una proteina estranea. La matrice lipidica-nanoparticellare consente una biodistribuzione diffusa dei codici genetici mRNA alle cellule della maggior parte o di tutti gli organi. La successiva espressione della proteina spike sulla superficie delle cellule e come proteina solubile all’interno degli organi e del flusso sanguigno induce la distruzione di cellule e tessuti da parte dei linfociti T e la formazione di anticorpi da parte dei linfociti B. Questi ultimi possono anche causare il deposito di immunocomplessi. Questi ultimi possono anche causare la deposizione di immunocomplessi che danneggiano ulteriormente i tessuti attraverso l’ipersensibilità di tipo III.
La proteina spike può quindi causare danni ai tessuti attraverso reazioni autoimmuni, anche se è “non tossica”. Sebbene ciò sia di lieve entità in un muscolo come il deltoide, provoca eventi avversi gravi e fatali quando si verificano in organi critici come il cervello, le ovaie e il cuore. Il metodo di somministrazione – la terapia genica con l’RNA attraverso nanoparticelle lipidiche che attraversano le membrane biologiche – è un problema centrale e un motivo fondamentale per cui questa tecnologia non è mai stata commercializzata, fino ad ora.
Il fatto che Moderna e altre grandi aziende farmaceutiche stiano pianificando la produzione di vaccini a base di mRNA su larga scala per molte altre malattie, in assenza di un’indagine completa e dettagliata, è quindi profondamente preoccupante.
6.10. Fisiopatologia del virus e della proteina spike del vaccino
Il decorso naturale dei nuovi virus pandemici/epidemici è quello di diventare più infettivi e meno patogeni con il tempo. Questo è stato chiaramente il caso della SARS-CoV-2, dove il ceppo originale di Wuhan e le successive varianti alfa e altre varianti iniziali erano abbastanza patogene, la variante delta si è diffusa più facilmente ma era un po’ meno patogena, e le varie sottovarianti omicron sono state altamente infettive ma ancora meno patogene in termini di gravità della malattia. In particolare, le sottovarianti omicron hanno preso di mira le vie respiratorie superiori piuttosto che quelle inferiori, con una minore penetrazione sistemica del virus e della proteina spike [83].
D’altra parte, i vaccini a mRNA e adenovettore-DNA inducono le cellule umane a produrre una versione leggermente modificata della proteina spike del ceppo originale di Wuhan. Alcune dosi di richiamo “bivalenti” aggiungono il codice genetico per la proteina spike della variante omicron [84,85]. Se un individuo subisce un’ampia biodistribuzione di questo codice genetico, possono essere prodotte a livello sistemico molte più proteine spike di quanto non avvenga generalmente con il virus naturale. Questo è più probabile per chi è giovane e in salute. Gli anziani e le persone con comorbidità hanno un rischio maggiore di contrarre una grave infezione virale da SARS-CoV-2 in profondità nei polmoni e a livello sistemico, mentre i giovani e i sani tendono a liberarsi del virus nella mucosa respiratoria superiore. Pertanto, nei giovani e nei sani i vaccini COVID-19 basati sulla codifica trasfettano un insieme di tessuti molto più diversificato rispetto all’infezione da parte del virus stesso.
Molti studi hanno dimostrato che la proteina spike è tossica. In “Understanding the Pharmacology of COVID-19 mRNA Vaccines: Playing Dice with the Spike?”, Cosentino e Marino (2022) hanno esaminato le prove della tossicità della proteina spike [86]. Essi hanno sostenuto che i vaccini a base di mRNA COVID-19 dovrebbero essere giustamente descritti come “prodrugs”, in quanto soddisfano la definizione del dizionario: “una sostanza farmacologicamente inattiva che viene convertita nell’organismo (per azione enzimatica) in un farmaco farmacologicamente attivo”. Ciò avviene attraverso l’azione dell’mRNA nei ribosomi per provocare la sintesi della proteina spike [86] (p. 3).
Cosentino e Marino (2022) hanno esaminato le prove di una diffusa biodistribuzione dell’mRNA e hanno concluso che “le prove supportano fortemente il possibile legame tra l’espressione inappropriata della proteina S nei tessuti sensibili e il conseguente danno tissutale” [86] (p. 2).
Hanno esaminato la letteratura sulla farmacologia e sugli effetti fisiopatologici della proteina spike sui tessuti corporei, che include [86] (p. 4-5):
Il legame con i recettori ACE-2 come “potenziale fattore scatenante dell’aggregazione piastrinica, della trombosi e dell’infiammazione, nonché dell’ipertensione e di altre malattie cardiovascolari”.
L’interruzione della glicoproteina transmembrana CD147, che interferisce con la funzione dei periciti cardiaci e degli eritrociti, può provocare miocardite, anemia emolitica, iperviscosità del sangue ed eventualmente processi neurodegenerativi.
Il legame ai recettori Toll-like 2 e 4 (TLR2, TLR4), con effetti patogeni teorici attraverso l’aumento delle cascate di citochine infiammatorie, dovuti a (1) attivazione del fattore nucleare kappa B (via NF-κB) e deficit della funzione immunitaria dei macrofagi attraverso il TLR2, e (2) danno polmonare, miocardite e lesioni multiorgano attraverso il TLR4, non è stato ancora adeguatamente studiato dalla comunità di ricerca mondiale.
Il legame con il recettore estrogenico alfa (ER alfa) ad alta affinità è probabilmente responsabile delle irregolarità mestruali comunemente osservate dopo la vaccinazione con COVID-19 e solleva preoccupazioni per un potenziale coinvolgimento nel cancro al seno.
La subunità S2 della proteina Spike interagisce specificamente con le proteine p53 BP1 e BRCA1. La p53 BP1 è un soppressore tumorale ben noto; la BRCA1 è frequentemente mutata sia nel cancro al seno che nel cancro alla prostata [87].
Cosentino e Marino hanno osservato che questi “potenziali problemi tossicologici” non sono stati “presi in considerazione negli studi che hanno portato all’autorizzazione all’immissione in commercio, proprio perché … questi prodotti sono stati trattati come vaccini convenzionali”, mentre in realtà si tratta di inserzioni geniche che agiscono come prodromi [86] (p. 5).
Una ricerca in vitro ha rilevato che il dominio di legame del recettore (RBD) della proteina spike (l’unità S1) è l’agente più attivo nell’innescare una risposta pro-infiammatoria da parte delle cellule dendritiche [88].
Ulteriori ricerche in vitro con cellule muscolari ed endoteliali dell’arteria polmonare umana trattate con la proteina spike completa o con il solo RBD, hanno rilevato che in questo caso l’RBD era relativamente inerte, ma la proteina spike completa induceva l’allargamento delle cellule vascolari polmonari attraverso la fosforilazione della proteina MEK (mitogen-activated protein kinase kinase) [89]. Questo è stato riscontrato anche in vivo, quando la somministrazione intratracheale dell’unità S1/RBD in topi transgenici con ACE-2 umano sulle loro cellule ha mostrato un drammatico aumento delle citochine infiammatorie nel liquido di lavaggio bronchiale dei topi che hanno ricevuto l’unità S1 della proteina spike, mentre questo era minimo per i topi di controllo (soluzione fisiologica intratracheale) e lieve e tardivo per i topi a cui è stata somministrata l’intera proteina spike, indicando che la scissione dell’unità S1 (RBD) aumenta la patologia associata all’ACE-2 [90].
L’iniezione di topi, allevati per avere recettori ACE-2 simili a quelli umani, con l’unità S1/RBD della proteina spike è risultata in grado di indurre una patologia polmonare acuta simile a quella del COVID-19, indicando che è la proteina spike, a meno che non sia stata modificata come nel vaccino australino-iraniano Spikogen [78,79], a essere una citotossina principalmente responsabile della gravità dell’infezione respiratoria da SARS-CoV-2 [86]. Questo, a posteriori, significa che è stata una scelta particolarmente povera per lo sviluppo di vaccini.
In un preprint, McKernan et al. [91] quantificano la farmacocinetica dei vaccini a base di mRNA come la creazione di un numero maggiore di proteine spike rispetto al virus SARS-CoV-2, e in modo più sistemico nella maggior parte delle persone non soggette a un’infezione virale COVID-19 eccessiva:
“La farmacocinetica dell’iniezione è diversa da quella di un’infezione; 30-100 µg per iniezione (90-300 µg per quelli potenziati) di Spike mRNA equivalgono a 13 trilioni-40 trilioni di molecole di mRNA iniettate in pochi secondi ad ogni iniezione. La farmacocinetica di questa iniezione in bolo è diversa da quella della replicazione virale, che avviene nell’arco di alcuni giorni. Se ognuno di questi mRNA può produrre 10-100 proteine spike e si hanno 30-40 trilioni di cellule, la quantità sistemica e la durata dell’esposizione alle proteine spike attraverso la via della vaccinazione possono essere molto maggiori rispetto all’infezione naturale”.
[91] (p.12)
La produzione di antigeni da parte dei tessuti umani significa che la dose può variare da un individuo all’altro. Ciò sarà dovuto alla genetica e alla fisiologia individuale, ai tessuti esposti al codice, alla variabilità dei lotti e delle fiale del prodotto e alle modalità di trasporto, refrigerazione e somministrazione. In termini di principio tossicologico dosis sola facit venenum (la dose fa il veleno), questo aspetto da solo mette in dubbio la sicurezza dei vaccini a mRNA e a DNA con vettore virale.
All’incirca nel periodo in cui i vaccini COVID-19 sono stati rilasciati al pubblico, i ricercatori del Salk Institute hanno scoperto che il virus SARS-CoV-2 si basa sul legame della proteina spike con i recettori ACE-2 delle cellule ospiti per entrare nelle cellule [92]. L’ACE-2 è protettivo per il sistema cardiovascolare e la proteina spike della SARS-CoV-2 favorisce il danno polmonare attraverso una diminuzione del livello di ACE-2. Il team del Salk Institute ha dimostrato che la proteina spike da sola può danneggiare le cellule endoteliali vascolari attraverso la downregulation dell’ACE-2, l’inibizione dell’ossido nitrico sintasi endoteliale (eNOS), la compromissione della funzione mitocondriale e la compromissione diretta della funzione endoteliale.
6.11. Interruzione della via colinergica nicotinica antinfiammatoria
Dosi elevate di dominio di legame della proteina spike simile alla tossina (RBD) inibiscono le risposte dei nAChR α7 indotte dall’acetilcolina (ACh). L’inibizione di questi α7 nACHR ha effetti profondi [33]. Il sistema colinergico nicotinico è stato definito “via colinergica antinfiammatoria” (CAP), poiché l’attivazione di questi recettori controlla l’infiammazione e la loro inibizione provoca un’infiammazione incontrollata. La CAP forma una rete sfaccettata, distribuita nelle cellule neuronali e non neuronali, con funzioni diverse in tutto l’organismo. Oltre che nel sistema nervoso, gli α7 nAChR sono espressi in cellule non neuronali come linfociti, monociti, macrofagi, cellule dendritiche, adipociti, cheratinociti, cellule endoteliali e cellule epiteliali dell’intestino e del polmone. Con una distribuzione così diffusa, i nAChR potrebbero essere coinvolti nella fisiopatologia della COVID-19 grave attraverso meccanismi, sia attraverso che indipendenti dalla via colinergica antinfiammatoria [32].
La modulazione della risposta infiammatoria e immunitaria da parte del SNC attraverso il nervo vago si basa sulla comunicazione bidirezionale tra il sistema immunitario e quello nervoso. Le fibre del nervo vago afferenti, situate nel nucleo tractus solitarius, forniscono al SNC un input sensoriale sullo stato infiammatorio che può portare alla trasmissione di segnali efferenti, provenienti dal nucleo motore dorsale, per controllare la risposta infiammatoria. Tale risposta è rapida e localizzata, a differenza della rete antinfiammatoria diffusibile, che è lenta, distribuita, non integrata e dipendente da gradienti di concentrazione [32].
Attivati attraverso il rilascio di ACh da parte del nervo vagale, i nACHR si trovano nel sistema immunitario su cellule T, cellule B, macrofagi, monociti, neutrofili e mastociti e agiscono per ridurre l’infiammazione, compresa la riduzione di citochine proinfiammatorie, come l’IL-6, promuovendo al contempo citochine antinfiammatorie come l’IL-4 [93]. La disregolazione dei nAChR da parte del SARS-CoV-2 potrebbe anche sopprimere il contrappeso al sistema nervoso simpatico e quindi promuovere la spinta simpatica centrale e lo sviluppo della tempesta di citochine guidata dal simpatico [94]. A sua volta, la tempesta simpatica innesca lo stress ossidativo e l’iperinfiammazione aumentando la generazione di specie reattive dell’ossigeno (ROS) e il rilascio di citochine pro-infiammatorie.
I NAChR si trovano anche nelle vie respiratorie. I nAChR del sottotipo α3β4 supportano la funzione delle cilia e la clearance mucociliare, mentre la stimolazione dei nAChR α7 è antinfiammatoria. Pertanto, l’inibizione di entrambi questi tipi di recettori, come la proteina spike è in grado di fare, contribuirebbe in modo significativo alla patologia polmonare osservata sia nella COVID-19 acuta che nella COVID lunga [95].
Lo stress indotto dall’infezione da SARS-CoV-2 e la soppressione delle vie colinergiche attraverso l’inibizione dei nAChR possono anche attivare il sistema nervoso simpatico (SNS) portando alla stimolazione neuro-ormonale e all’attivazione di citochine pro-infiammatorie con ulteriore sviluppo di una tempesta simpatica. L’iperattivazione simpatica in COVID-19 è correlata a un aumento della perdita capillare polmonare, al danno alveolare e allo sviluppo della sindrome da distress respiratorio acuto. Inoltre, il SARS-CoV-2 può diffondersi attraverso i meccanorecettori polmonari e i chemorecettori al centro respiratorio midollare in modo retrogrado, provocando un’improvvisa insufficienza respiratoria a causa dell’inibizione dei nAChR nei centri parasimpatici midollari [96].
Una volta infettata la persona con il SARS-CoV-2, il sistema immunitario si mobilita. Quando il virus si replica, i detriti cellulari e virali o i virioni possono interagire con i nAChR e bloccare la via colinergica antinfiammatoria. Se la risposta immunitaria iniziale non è sufficiente a combattere l’invasione virale in una fase iniziale, la replicazione estesa e prolungata del virus finirà per interrompere la via colinergica antinfiammatoria e compromettere seriamente la capacità di controllare e regolare la risposta immunitaria. L’azione incontrollata delle citochine pro-infiammatorie porterà allo sviluppo di una tempesta di citochine, con lesioni polmonari acute e sindrome da distress respiratorio acuto (ARDS), disturbi della coagulazione e insufficienza multiorgano. Sulla base di questa ipotesi, la COVID-19 sembra diventare una malattia del sistema colinergico nicotinico [92].
Questo stesso meccanismo può spiegare sia l’ampiezza e la gravità dei sintomi riscontrati nella COVID lunga che nelle lesioni da vaccino COVID-19. Nel primo caso si assiste a una mancata eliminazione della proteina spike e del virus, con attivazione immunitaria incontrollata e sequele [97], mentre nel secondo caso di lesioni da vaccino, in cui la proteina spike sovraccarica il sistema e viene prodotta per mesi, si assiste a un aumento del carico a ogni iniezione successiva. Questo fornisce anche un meccanismo per possibili interventi con agonisti α7 nAChR e modulatori allosterici positivi (PAMS).
7. Prove di “spikeopatia” – patogenicità della proteina spike
La proteina spike del SARS-CoV-2 si è rivelata patogena. È stato coniato il termine “spikopatia” [98] poiché i suoi effetti patologici, come quelli della tubercolosi, sembrano essere numerosi, diffusi negli organi del corpo e inducono una miriade di malattie e sindromi note. Il termine è scritto “spikeopathy” da altri su Internet e noi abbiamo scelto questa grafia.
La Figura 6 mostra che la FDA era a conoscenza di questo potenziale prima del rilascio pubblico dei vaccini COVID-19 basati sul gene. Si tratta della 16a diapositiva di una presentazione PowerPoint del “Vaccines and Related Biological Products Advisory Committee (VRBPAC) 22 October 2020, Meeting” [99]. Ciò che colpisce è l’accuratezza predittiva di questi “possibili eventi avversi”, per lo più di natura neurologica, cardiovascolare e autoimmune, rispetto a quelli segnalati al VAERS e ad altri database globali di lesioni da vaccino.

Figura 6. Diapositiva 16 della riunione del VRBPAC della FDA, ottobre 2022 [99].
Il sito web www.react19.org elenca, a giugno 2023, oltre 3400 articoli pubblicati e case report sui danni del vaccino COVID-19, suddivisi in oltre venti sistemi d’organo e sindromi [100]. In questa sede, esamineremo alcuni sistemi d’organo chiave in relazione agli effetti patogeni dell’mRNA di COVID-19 e delle proteine spike prodotte dall’adenovettore DNA.
7.1. Patogenesi cardiovascolare
Si accumula letteratura sui danni cardiovascolari dei vaccini COVID-19. Ad esempio, a giugno 2023 il sito react19.org, alla voce “Cardiac”, elenca 432 articoli peer-reviewed e case report riguardanti miocardite, cardiomiopatia, infarto miocardico, ipertensione, dissezione aortica, sindrome da tachicardia ortostatica posturale (POTS), tachicardia e disturbi della conduzione [100].
7.1.1. Miocardite e pericardite
Le segnalazioni di miocardite e pericardite sono particolarmente numerose. Yonker et al. [54] hanno trovato proteine spike libere nel sangue di 16 adolescenti e giovani adulti che hanno sviluppato una miocardite post-vaccinazione, ma non in 45 controlli post-vaccinazione di pari età senza miocardite. Gli autori hanno esaminato i profili immunitari e le concentrazioni plasmatiche di proteine spike libere in soggetti giovani con miocardite dopo la vaccinazione con i vaccini a mRNA COVID-19. Nei pazienti affetti da miocardite sono state riscontrate concentrazioni significativamente elevate di proteine spike libere a lunghezza intera, non legate agli anticorpi, rispetto ai controlli. I profili anticorpali e le risposte delle cellule T erano simili tra i soggetti affetti da miocardite e i controlli accuratamente abbinati per età, ma si può pensare che parte della varianza osservata per quanto riguarda la miocardite come complicazione della vaccinazione con mRNA, possa essere spiegata dal fatto che alcuni raggiungono una maggiore trascrizione e secrezione nel sangue. Ciò solleva serie preoccupazioni sulla patogenicità della proteina spike libera in questi casi di miocardite
.Avolio et al. [101] hanno scoperto che la proteina spike libera del SARS-CoV-2, separata dal virus, può causare malattie microvascolari attraverso diversi meccanismi, tra cui la stimolazione dei periciti cardiaci a impegnarsi nella produzione di citochine pro-infiammatorie attraverso il legame con il recettore CD147. Un’ulteriore prova della patogenicità della proteina spike proviene da studi sui topi, in cui la fibrosi cardiaca indotta dalla proteina spike e la compromissione della contrattilità del miocardio possono essere alla base della cardiomiopatia legata a COVID-19 [102].
La possibilità che la miocardite associata al vaccino COVID-19, a differenza della miocardite da ipersensibilità osservata con agenti come il vaccino antivaioloso, sia in realtà autoimmune, è presa in considerazione da Baumeier e colleghi [103] in una serie che descrive 15 casi con biopsie endomiocardiche (EMB), uno studio discusso in una sezione successiva di questo documento. Come in altri studi e case report, l’infiltrazione linfocitaria è stata osservata in associazione con l’espressione di spike intracardiaci (sebbene gli autori non abbiano fatto specifico riferimento alle caratteristiche di biodistribuzione delle nanoparticelle lipidiche).
Barmada et al. [104], in un recente studio di Yale, alla luce dei risultati di Yonker et al. [54] e Baumeier et al. [103], valutano se il mimetismo molecolare indotto dagli spike sia il motore dell’attacco miocardico autoimmune. Essi escludono efficacemente questa possibilità in uno studio sul siero utilizzando il REAP, un “rapid extracellular antigen profiling screen” per gli autoanticorpi. Inoltre, ipotizzano una “citochinopatia”, con riferimento ai profili di citochine nel siero e ad altri marcatori di infiammazione in un sottogruppo, ma non riportano le concentrazioni ematiche della proteina spike, né ottengono tessuto miocardico.
Da quanto detto sopra, sebbene rimangano ancora molti studi di laboratorio sull’infiammazione miocardica che si osserva in modo preponderante dopo le vaccinazioni con mRNA, sembra che la proteina spike svolga un ruolo. Sebbene il mimetismo molecolare non sia la causa, potrebbero essere implicati effetti tossici diretti della proteina spike, oltre alla reazione del sistema immunitario alla presenza della proteina spike, espressa o depositata nel miocardio. Il fatto che la miocardite sia precipitata dalla spikeopatia è ulteriormente indicato dal fatto che i vaccini COVID-19 adenovectorDNA di AstraZeneca e Johnson & Johnson, così come il vaccino Novavax a base di proteine e nanoparticelle lipidiche, sono stati segnalati come causali [105,106].
Quanto è comune la miocardite e la pericardite indotte dal vaccino COVID-19? Come base di riferimento, uno studio pubblicato il 7 gennaio 2020, alla vigilia della pandemia di SARS-CoV-2, riporta che: “La miocardite virale ha un tasso di incidenza compreso tra 10 e 22 per 100.000 individui [107].
Per quanto riguarda l’incidenza epidemiologica comunitaria, una revisione del New England Journal of Medicine [108] ha osservato che il tasso di incidenza annuale dipendeva dal livello di indagine:
“Prima della pandemia COVID-19, l’incidenza globale stimata della miocardite era di 1-10 casi per 100.000 persone all’anno (12). Il rischio maggiore si registrava tra le persone di età compresa tra i 20 e i 40 anni e tra gli uomini; 6,1 casi per 100.000 uomini e 4,4 casi per 100.000 donne. L’aumento dell’uso della risonanza magnetica cardiaca ha portato a un graduale aumento dell’incidenza riportata di miocardite negli Stati Uniti, da 9,5 a 14,4 casi per 100.000″.
[108] (p. 1488)
Autorità sanitarie come la FDA, il TGA e altri enti regolatori hanno affermato che la miocardite successiva alla vaccinazione contro il vaccino COVID-19 è molto rara. Un primo studio su 2,39 milioni di adulti californiani assicurati presso Kaiser Permanente che avevano ricevuto almeno una dose di vaccino COVID-19 di Pfizer o Moderna ha rilevato solo 15 casi di miocardite post-vaccino, tutti maschi con un’età media di 25 anni [109]. Tuttavia, i casi si basavano sulle segnalazioni dei medici al comitato di immunizzazione di Kaiser Permanente o sui casi ospedalizzati entro 10 giorni dalla vaccinazione. I casi più lievi potrebbero essere stati tralasciati; i medici potrebbero non aver sempre segnalato i casi al comitato.
Una revisione sistematica delle segnalazioni di farmacovigilanza ai database VAERS degli Stati Uniti, Yellow Card del Regno Unito e EudraVigilance dell’UE fino al 16 marzo 2022, ha rilevato 18.204 eventi di miocardite e/o pericardite, alcuni dei quali fatali [110]. Considerando le centinaia di milioni di persone che ricevono il vaccino, gli autori hanno notato che si tratta di un evento raro.
L’FDA ha riconosciuto che il rischio di miocardite e pericardite derivante dai vaccini COVID-19 mRNA è reale, soprattutto nei maschi più giovani dopo la seconda dose, ma lo ha giudicato ancora raro e ha citato un dato derivato da VAERS di 6,5 su 100.000 e fino a 20 su 100.000 per i ragazzi adolescenti [111]. L’FDA non ha calcolato che i database di farmacovigilanza, come il FAERS (FDA Adverse Event Report System) e il VAERS dei CDC, hanno un ampio fattore di sottosegnalazione.
Un fattore comune a queste stime della FDA, così come a quelle di altri, è la mancata menzione del problema perenne della sotto-segnalazione nei sistemi di notifica passiva. È noto che i database di farmacovigilanza, come il FAERS e il VAERS dei CDC, presentano ampi fattori di sottosegnalazione. Quanto sia grande il fattore di sotto-segnalazione è oggetto di dibattito.
Ad aggravare il fenomeno della sotto-segnalazione nel caso della miocardite, c’è il fatto che questa diagnosi è difficile da fare e spesso dipende dalla disponibilità di unità specializzate, di strutture per la risonanza magnetica cardiaca e/o di biopsia endomiocardica (EMB). La diagnosi può mimare l’infarto del miocardio e quindi può essere mal diagnosticata. A questo proposito, il lavoro di Baumeier et al. [103] (discusso più avanti in questo articolo), ha osservato che un terzo dei soggetti con miocardite confermata istologicamente, classificati come vaccino-associati sulla base dell’anamnesi e dell’esclusione di altri agenti causali, non aveva evidenza di miocardite alla RMN cardiaca. Inoltre, molti casi di miocardite sono subclinici e possono essere trascurati nella fase acuta.
Ciò non significa, tuttavia, che ci si aspetti sempre un decorso benigno, poiché anche la fibrosi e la cicatrizzazione minori del miocardio possono creare focolai aritmogeni e presentarsi in seguito con aritmie gravi e fatali, oppure possono portare all’insufficienza cardiaca (la cosiddetta cardiomiopatia infiammatoria) [112]. Pertanto, è ragionevole affermare che l’esatta frequenza della miocardite associata al vaccino è sconosciuta: i casi possono essere subclinici, mancati o classificati in modo errato e anche la diagnostica per immagini specializzata può sottodiagnosticare.
Un’indicazione di quanto possa essere comune la miocardite subclinica, o almeno il coinvolgimento del miocardio, viene da uno studio prospettico condotto in Thailandia. Adolescenti (n = 301) senza anamnesi cardiaca sono stati sottoposti a biomarcatori cardiaci (troponina-T, creatinina chinasi-banda (CK-MB)), ECG, ecocardiografia e diario dei sintomi cardiaci al basale e nei giorni 3, 7 e 14 dopo la seconda dose di vaccino Pfizer mRNA COVID-19 [113]. Sebbene non vi fosse un gruppo di controllo, i risultati del diario, dell’esame fisico e dell’ECG sono preoccupanti: “tachicardia (7,64%), mancanza di respiro (6,64%), palpitazione (4,32%) e ipertensione (3,99%)” (p. 4). Cinquantaquattro adolescenti (18%) presentavano ECG anormali. L’elevazione della troponina si è verificata in cinque adolescenti, l’ecocardiografia ha rilevato versamenti pericardici in tre adolescenti e i segni di miopericardite in un adolescente hanno portato al ricovero in terapia intensiva. In totale, sette adolescenti hanno presentato “miopericardite, miocardite subclinica e pericardite dopo la seconda dose di vaccinazione”, ma a parte l’adolescente ricoverato in terapia intensiva, gli altri sei casi erano subclinici o lievi e facilmente mancati se non fosse stato per questo rigoroso studio prospettico [113] (p. 8, Tabella 3).
Sebbene questo studio tailandese, eccellente dal punto di vista metodologico, non sia stato replicato in termini di manoscritto completo, un abstract della conferenza ha suggerito risultati comparabili, con una metodologia più semplice [114]. Su 777 operatori sanitari dell’Ospedale universitario di Basilea che hanno ricevuto una vaccinazione di richiamo COVID-19 tra la fine del 2021 e l’inizio del 2022, è stata rilevata un’evidenza di cardiomonecrosi (troponinemia) in 22 (2,8%), senza alcuna causa diversa dall’iniezione di richiamo Moderna COVID-19 mRNA-1273 [114]. Anche se in una popolazione diversa, che riceveva la seconda dose di vaccino mRNA, lo studio tailandese ha riportato un tasso di miocardite o pericardite del 2,3%. Considerando che sono state somministrate miliardi di dosi alla popolazione umana, ciò equivale a 2300 casi ogni 100.000 persone. Poiché tutti i casi erano di sesso maschile, il tasso era del 3,5% per gli adolescenti maschi [113].
Sebbene le autorità sanitarie affermino che la miocardite da vaccino COVID-19 è lieve e autolimitante, è dimostrato che, nonostante i sintomi, i cambiamenti patologici in questi giovani cuori sono persistenti. Uno studio italiano ha seguito per 12 settimane 13 casi di miopericardite, miocardite o pericardite indotta da vaccino post-mRNA, di età media 15 anni. Sebbene i sintomi evidenti in tutti i casi tranne uno si siano risolti, 12 dei 13 adolescenti presentavano ancora un versamento pericardico e sei dei nove sottoposti a risonanza magnetica cardiaca presentavano segni di “lesione miocardica persistente, sebbene ridotta” al termine dello studio [115].
La miocardite subclinica che induce fibrosi cardiaca come focolaio per una successiva aritmia sotto sforzo è una possibile spiegazione dell’epidemia di morti improvvise nei giovani e negli adulti di giovane e media età dall’avvento dei vaccini COVID-19 [116,117]. Questa possibilità è stata rilevata dal TGA all’inizio dell’introduzione del vaccino [118]:
“Anche episodi apparentemente lievi di miocardite possono portare a sequele a lungo termine, come aritmie. … la maggior parte dei casi di miocardite e/o pericardite dopo i vaccini COVID-19 a mRNA (sia Pfizer che Moderna) analizzati finora si è verificata in adolescenti e giovani adulti più grandi (di età compresa tra i 16 e i 30 anni), con il rischio più elevato nei maschi più giovani nei giorni successivi alla dose 2″.[118] (p. 8)
7.1.2. Effetti trombotici delle proteine spike
In modo diverso dalla patogenesi della miocardite, il legame della proteina spike indotta dal vaccino COVID-19 con i recettori ACE-2 può innescare l’aggregazione piastrinica, la trombosi e l’infiammazione, portando così alla formazione di coaguli di sangue [119,120]. Angeli et al. [99] riassumono il percorso biochimico di questi effetti fisiopatologici:
“Le proteine Spike libere rilasciate dalle cellule distrutte e precedentemente bersagliate dai vaccini possono interagire con l’ACE-2 di altre cellule, promuovendo così l’internalizzazione e la degradazione dell’ACE-2 (16,79). Questo meccanismo può aumentare lo squilibrio tra l’iperattività dell’Ang-II e la carenza di Ang-1-7 attraverso la perdita dell’attività del recettore dell’ACE-2, che può contribuire a scatenare l’infiammazione, la trombosi, l’aumento della pressione arteriosa e altre reazioni avverse (“effetto Spike” dei vaccini COVID-19) (80,81). Inoltre, gli effetti dannosi della carenza di altre angiotensinasi (POP e PRCP) su BP, trombosi e infiammazione sono ben supportati”.
Gli autori descrivono i meccanismi per cui questi effetti coagulativi sono più comuni nei pazienti più giovani. Le angiotensinasi prolil oligopeptidasi (POP) e prolil carbossipeptidasi (PRCP) diventano carenti nelle persone anziane con malattie cardiovascolari e paradossalmente questo si traduce in una minore suscettibilità alla patogenesi cardiovascolare indotta dalla proteina spike, mentre nelle persone più giovani il rischio aumenta:
“La carenza relativa di POP e PRCP tra i soggetti giovani e sani non controbilancia l’internalizzazione, la downregulation e il malfunzionamento dell’ACE-2 a causa delle interazioni con la proteina Spike, con conseguente aumento del rischio di accumulo di Ang-II e di reazioni avverse (“effetto Spike” dei vaccini COVID-19)”.[120] (p. 26)
Essi propongono inoltre che l’immunità preesistente dovuta all’infezione da SARS-CoV-2 o a una precedente vaccinazione induca una maggiore risposta immunitaria alla produzione di proteine spike da parte di cellule, quali piastrine, cellule vascolari endoteliali o miociti, con conseguente aumento dell’infiammazione e dell’attività trombogenica. Angeli et al. [119] concludono che:
Mentre gli studi sui vaccini di Fase III hanno generalmente escluso i partecipanti con una precedente immunizzazione, la vaccinazione di enormi popolazioni nella vita reale includerà inevitabilmente individui con un’immunità preesistente. Questo potrebbe portare a reazioni infiammatorie e trombotiche eccessivamente accentuate in soggetti occasionali. Ulteriori ricerche sono urgentemente necessarie in quest’area.
La microscopia elettronica dal vivo ha dimostrato che le proteine spike libere innescano la deformazione e la coagulazione delle piastrine attraverso l’induzione dei filopodi e l’interazione delle proteine spike con le integrine piastriniche per causare coagulopatia [121]. All’inizio della pandemia, topi trasfusi con piastrine transgeniche umane dotate di recettori ACE-2 hanno sviluppato trombi dovuti al legame della proteina spike con i recettori ACE-2 delle piastrine [1]. Gli autori hanno osservato che:
“Il SARS-CoV-2 e la sua proteina Spike stimolavano direttamente le piastrine per facilitare il rilascio di fattori di coagulazione, la secrezione di fattori infiammatori e la formazione di aggregati leucocito-piastrinici”.
È stato inoltre riscontrato che la proteina spike “inibisce in modo competitivo i legami dell’antitrombina e del cofattore eparinico II con l’eparina/HS, causando un aumento anomalo dell’attività della trombina” [122]. In un altro studio sui topi, è stato riscontrato che la proteina spike “si lega al fattore di coagulazione del sangue fibrinogeno e induce coaguli di sangue strutturalmente anormali con una maggiore attività proinfiammatoria” e che “spike ritarda la fibrinolisi” [123] (preprint).
I ricercatori francesi dell’Istituto Méditerranée Infection di Marsiglia hanno esaminato gli effetti delle proteine spike della variante SARS-CoV-2 Wuhan, alfa, delta e omicron BA.1 sui globuli rossi (eritrociti) in vitro ed è emerso che la proteina spike ha indotto l’emoagglutinazione (raggruppamento) degli eritrociti, la variante omicron BA.1 l’ha ottenuta a concentrazioni inferiori, fino a 0,13 ng/µL, mentre le varianti precedenti fino a una concentrazione di 0,13 ng/µL. Il meccanismo d’azione è stato dedotto tramite modellazione molecolare dalla carica positiva della proteina spike che riduce la naturale repulsione elettrostatica degli eritrociti con carica negativa. È interessante notare che l’ivermectina, aggiunta alla soluzione in vitro, si è legata fortemente alla proteina spike e ha impedito o invertito l’emoagglutinazione a seconda che fosse aggiunta prima o dopo la proteina spike. Gli autori sottolineano le implicazioni per il trattamento degli effetti avversi del vaccino [124].
Si può ritenere che le membrane plasmatiche e interne di altre cellule eucariotiche funzionino con anioni e cationi che agiscono come un circuito di corrente per guidare il potenziale di membrana su entrambi i lati della membrana cellulare [125,126]. Il design unico del globulo rosso è un toroide in cui le correnti scorrono anche sulla superficie del toro. Se questo flusso statico sulla superficie della membrana dell’eritrocita viene interrotto dalla mancanza di separazione tra la carica superficiale negativa della membrana e lo strato di Stern, l’indebolimento del potenziale zeta porta alla distorsione della forma, alla diminuzione della permittività elettrica, all’aumento della viscosità, alla flocculazione e ad alterazioni reologiche [127]. Quando questo flusso di corrente superficiale è statico, con un’efficiente separazione dello strato di Stern carico positivamente e delle cariche superficiali negative della membrana, il potenziale zeta viene potenziato e le dimensioni, la forma, le proporzioni e la curvatura dell’eritrocita si trasformano nella forma ottimale. Gli eritrociti devono mantenere una forma discoidale biconcava per fornire in modo efficiente molecole di ossigeno (O2) e assorbire molecole di anidride carbonica (CO 2) [128]. L’interpolazione di una proteina con spike positivo nella membrana eritrocitaria con carica negativa può quindi comportare alterazioni significative della forma e della funzione degli eritrociti.
Le complicazioni trombotiche della vaccinazione COVID-19 coinvolgono molti meccanismi potenziali, come il danno alle cellule endoteliali, la risposta immunitaria, la disregolazione del sistema renina-angiotensina-aldosterone e la trombo-infiammazione. Inoltre, le piastrine contengono acetilcolina ed esprimono α7nAchR. L’acetilcolina agisce come inibitore endogeno dell’aggregazione piastrinica. La carenza di α7nAchR ematopoietico aumenta l’attivazione piastrinica e, in studi sperimentali, la stimolazione di α7nAchR può diminuire lo stato pro-infiammatorio e modulare la reattività piastrinica attraverso l’aumento dei livelli di ossido nitrico (NO). L’inibizione del nAChR piastrinico da parte del SARS-CoV-2 promuove quindi l’iperreattività piastrinica e la trombosi che sono caratteristiche della COVID-19 e del danno da vaccino [129].
Questi meccanismi spiegherebbero la coagulazione sia del virus che delle proteine spike prodotte dai vaccini COVID-19 basati sui geni. Ciò suggerisce anche che le politiche sanitarie pubbliche che hanno negato l’immunità naturale e hanno imposto la vaccinazione COVID-19 e i programmi di richiamo hanno esposto a un rischio maggiore la popolazione giovane e non anziana. Per illustrare questi maggiori rischi di danni, sono stati segnalati casi di cecità nei database di farmacovigilanza e un recente ampio studio sulle diagnosi di occlusione vascolare retinica negli Stati Uniti dal 1° gennaio 2020 al 31 dicembre 2022 ha rilevato che gli individui vaccinati con COVID-19 con i vaccini Moderna, Pfizer o AstraZeneca COVID-19 presentavano un rischio aumentato di 2,19 hazard ratio rispetto agli americani non vaccinati [130].
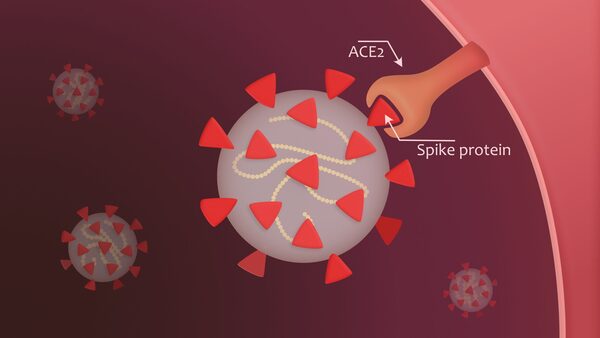
7.1.3. Trombocitopenia immunitaria indotta da vaccino (VITT)
A differenza del ruolo della proteina spike nella miopericardite e nella trombogenesi descritte in precedenza, la sindrome della trombocitopenia immune indotta da vaccino (VITT) osservata con i vaccini adenovectorDNA di AstraZeneca e Johnson & Johnson, nonché con il vaccino adenovectorDNA Russian Sputnik V [131], è una condizione rara mediata da anticorpi anti-PF4 delle piastrine. Sembra non essere correlata alla proteina spike e si stanno studiando altri componenti della tecnologia adenovectorDNA [132]. È strano che questi vaccini siano stati per lo più ritirati dal mercato, mentre non lo sono stati i vaccini COVID-19 a base di mRNA che presentano problemi simili, anche se con meccanismi fisiopatologici diversi.
Oltre alla presenza di anticorpi anti-PF4 nella patogenesi della VITT, numerosi autori hanno discusso l’evidenza del ruolo della NETosi (trappole extracellulari dei neutrofili) come base della trombilia osservata nei vaccini con vettori adenovirali, indipendentemente dalla proteinemia di punta [133,134]. È interessante notare che Talotta e Robertson discutono la possibilità che anche la NETosi possa avere un ruolo nelle conseguenze trombofiliche dei vaccini a base di mRNA, notando ad esempio che l’RNA nudo, se sfugge ai confini del vettore LNP e fuoriesce nel flusso sanguigno, può agire come innesco della NETosi [135].
7.2. Malattie autoimmuni
Nel 2020, prima del lancio dei vaccini, Lyons-Weiler ha suggerito che più di un terzo delle proteine di COVID-19, compresa la proteina spike, mostra un’omologia problematica con proteine chiave del sistema immunitario umano. Esiste quindi un potenziale di reazioni autoimmuni contro queste proteine [8]. Vojdani et al. [9] hanno citato Lyons-Weiler e sono andati oltre nei loro test, eseguendo una mappatura degli epitopi e applicando anticorpi monoclonali anti proteina spike e nucleoproteina del SARS-CoV-2 a 55 antigeni di tessuti umani in vitro. Hanno scoperto che gli anticorpi anti-SARS-CoV-2 reagivano con 28 degli antigeni tissutali, svolgendo così probabilmente “un ruolo nel processo patologico multisistemico della COVID-19” (abstract) e potendo precipitare o esacerbare le malattie autoimmuni. Il loro lavoro è stato presentato nell’ottobre 2020 e hanno notato precedenti storici di vaccini che causano disturbi legati all’autoimmunità e hanno espresso la preoccupazione che “un vaccino non sufficientemente controllato potrebbe significare scambiare la libertà dalla COVID-19 con un’aggressione autoimmune in futuro” (p. 2).
Vojdani e colleghi hanno scoperto che i 28 antigeni presentavano mimetismo molecolare/omologia condivisa e reattività con:
“proteine dell’intestino e della barriera, cellule del sistema gastrointestinale, tiroide, sistema nervoso, cuore, articolazioni, pelle, muscoli, mitocondri e malattie del fegato”.
[9] (p. 5)
Khavinson et al. in un articolo intitolato “Homology between SARS-CoV-2 and human proteins” (Omologia tra SARS-CoV-2 e proteine umane) hanno trovato più di due dozzine di eptameri e ottameri, omologhi alle proteine umane, alcuni dei quali si fondono in lunghezze estese lungo la lunghezza della proteina spike del SARS-CoV-2 [136]. Hanno osservato che, data la “somiglianza strutturale, una parte della risposta immunitaria sarà diretta contro le proteine dell’organismo ospite” (p. 1).
Kelleni riferisce del rischio potenziale dei vaccini di indurre malattie autoimmuni come trombocitopenia, miocardite e trombosi e tromboembolismo immuno-indotti, tutti potenzialmente fatali e possibili cause di morte improvvisa [137].
Più recentemente, un gruppo dell’Arabia Saudita ha riscontrato una chiara emergenza clinica di malattia autoimmune dopo la vaccinazione con COVID-19. Dopo la vaccinazione COVID-19 è stata descritta una serie di malattie autoimmuni esclusivamente di nuova insorgenza. Il tempo medio tra la vaccinazione e la comparsa della malattia è stato di 7 giorni. I casi comprendevano vasculiti, malattie neurologiche, lupus eritematoso sistemico, artrite infiammatoria e un caso di sindrome di Sjogren [138]. Una revisione sistematica di Rodríguez et al. ha documentato 928 casi da 464 rapporti pubblicati di malattie autoimmuni nuove o recidive dopo la vaccinazione COVID-19 [139]. Gli autori hanno osservato che:
“Le malattie più comuni associate a eventi di nuova insorgenza dopo la vaccinazione sono state la trombocitopenia immune, la miocardite e la sindrome di Guillain-Barré. Al contrario, la trombocitopenia immunitaria, la psoriasi, la nefropatia IgA e il lupus eritematoso sistemico sono state le malattie più comuni associate a episodi recidivanti”.
Dopo la revisione di Rodríguez et al. sono apparsi altri case report sottoposti a peer-review. Un piccolo campione comprende disturbi autoimmuni dermatologici e vascolari attribuiti ai vaccini COVID-19, tra cui il pemfigo IgA la cui “probabile causa” era il vaccino COVID-19 di AstraZeneca [140]; malattia bollosa autoimmune con autoanticorpi IgG e IgM contro la zona della membrana basale epidermica dopo il vaccino COVID-19 a base di mRNA [141]; poliarterite nodosa in un uomo di 32 anni con “dolore agli arti, febbre, embolia polmonare e noduli sottocutanei multipli ed ematomi” in seguito al vaccino COVID-19 [142].
Tra i casi di autoimmunità correlati alla tiroide e ai reni si segnalano il morbo di Graves in seguito alla seconda dose del vaccino COVID-19 di Pfizer [143] e la “nefropatia IgA rapidamente progressiva” in seguito alla terza dose del vaccino COVID-19 di Moderna [144]. Una donna di 78 anni ha sviluppato una sialadenite IgG4-correlata e una pancreatite autoimmune dopo il secondo vaccino Pfizer COVID-19, hanno concluso gli autori: “l’uso di vaccini a mRNA richiede ulteriori studi riguardo ai loro effetti sul sistema immunitario umano” [145] (pag. 1550).
Una donna di 23 anni ha avuto una reazione autoimmune oculare sotto forma di uveite anteriore granulomatosa in seguito al terzo vaccino Pfizer COVID-19 somministrato 15 giorni prima [146]. Gli autori hanno commentato:
“La reazione autoimmune nel tessuto uveale attraverso il mimetismo molecolare come risultato di una risposta immunitaria adattativa umorale e cellulare polispecifica contro gli epitopi può essere il potenziale meccanismo dell’uveite post-vaccino in questa paziente”.
(p. 1034)
Un case report di anemia aplastica associata all’epatite (HAAA) in seguito alla vaccinazione con COVID-19 in una ragazza giapponese di 15 anni [147] ha citato Talotta [148] e ha postulato che:
“I meccanismi patogenetici attraverso i quali la vaccinazione con mRNA innesca lo sviluppo della malattia autoimmune rimangono poco chiari. La vaccinazione con mRNA innesca una potenziale cross-reattività tra gli anticorpi contro la proteina spike e gli auto-antigeni e può anche attivare le risposte immunitarie, portando alla produzione di interferone I e di altre citochine e chemochine pro-infiammatorie.”
[148] (p. 3)
La ripetuta stimolazione antigenica dell’immunità, come avviene con la produzione prolungata di proteine spike da parte dei vaccini COVID-19 basati sui geni, le ripetute dosi di richiamo e le infezioni ricorrenti da SARS-CoV-2, ha visto un aumento dei livelli di IgG4 di oltre 480 volte rispetto ai livelli normali [149,150]. Questo spostamento di classe IgG può essere associato a gravi patologie legate alla morte cardiaca improvvisa [151,152].
È stato anche associato alla sindrome di Mikulicz con coinvolgimento sistemico, a malattie pancreato-epatobiliari, a malattie della testa/del collo, a fibrosi/aortite retroperitoneale [153,154,155,156], nonché a linfoadenopatia, sialadenite, dacrioadenite, pancreatite autoimmune, periaortite/fibrosi retroperitoneale, prostatite, colangite sclerosante, sinusite, pseudotumore infiammatorio, fibrosi mediastinica, coinvolgimento cutaneo, tiroidite sclerosante, ipofisite, orchite e colite [157,158,159,160].
Questi diffusi effetti autoimmuni e pro-infiammatori della proteina spike e potenzialmente delle nanoparticelle lipidiche illustrano la “spikeopatia” come un altro “grande imitatore” simile alla tubercolosi, che rende difficile la diagnosi dell’eziologia sottostante [161].
7.3. Disturbi neurologici
Il gruppo più comune di eventi avversi segnalati dai vaccini COVID-19 a base di geni nei database di farmacovigilanza, compresa la ricerca post-marketing di Pfizer [162,163], non è cardiovascolare ma neurologico. I sintomi neurologici e il deterioramento cognitivo con accelerazione della malattia neurodegenerativa sono una caratteristica della COVID-19 acuta, delle lesioni da vaccinazione e, in una certa misura, della COVID lunga [164].
Poiché il vettore lipidico-nanoparticellare dell’mRNA per la produzione delle proteine spike attraversa la barriera emato-encefalica, sono possibili effetti neurotossici diretti [43]. La perdita di impermeabilità della barriera emato-encefalica (BBB) è stata dimostrata dopo la vaccinazione con COVID-19 [165] e la proteina spike S1 può attraversare la BBB e traslocare nel parenchima cerebrale [166,167]. L’esperimento di coltura cellulare in vitro di cellule endoteliali cerebrali (un componente della BBB) ha dimostrato che la subunità S1 (RBD) si lega all’ACE-2 delle cellule endoteliali per attraversare la BBB. La subunità S1 è stata correlata a un’alterazione mitocondriale ed è entrata anche nel nucleo delle cellule; gli autori hanno ipotizzato che possa alterare l’espressione genica [168].
7.3.1. Aspetti neurovascolari e neuroimmunologici
In una certa misura, è probabile che la fisiopatologia avvenga attraverso la patologia vascolare e autoimmune nel sistema nervoso centrale e periferico. È stato riscontrato che la proteina spike, in colture cellulari umane in vitro, disregola i periciti vascolari cerebrali aumentando l’espressione dell’ACE-2 e portando queste cellule a rivestire la vascolarizzazione cerebrale e ad adottare un “fenotipo contrattile e miofibogenico”, nonché una “potente risposta infiammatoria” peggiorata dall’ipossia [169].
In ulteriori esperimenti sui topi, l’infusione della proteina spike nel cervello ha portato a una neuroinfiammazione mediata da TLR4 e alla microgliosi dell’ippocampo, con disfunzioni della memoria associate. Negli esseri umani è stato osservato che la disfunzione cognitiva post-COVID-19 era più probabile con un particolare genotipo TLR4 [170]. Ciò ha replicato un’analoga sperimentazione sui topi, che ha riscontrato che l’infusione della subunità S1 (RBD) nell’ippocampo dei topi ha indotto la morte cellulare e l’attivazione gliale e i topi hanno mostrato deficit cognitivi e comportamenti simili all’ansia [171].
Tillman et al. (2023) [172] hanno descritto come la co-espressione delle subunità S1 e S2 della proteina spike del SARS-CoV-2, attraverso un motivo elicoidale nel collo dello spike, provochi una profonda downregulation del nAChR α7 funzionale, che “è implicato in malattie neuropsichiatriche e interrompe la via colinergica antinfiammatoria” (p. 689). Ricercatori tedeschi [173] (preprint) hanno effettuato autopsie su topi a cui era stata iniettata per via endovenosa l’unità S1 della proteina spike e hanno esaminato crani di autopsie umane. Hanno trovato l’unità S1 legata alle cellule della maggior parte degli organi, comprese le ovaie e i testicoli. Nel cervello hanno riscontrato la presenza di S1 associata a un’espressione differenziale di proteine, dopo la nota espressione dei recettori ACE-2, nel midollo cranico, nelle meningi e nel parenchima cerebrale rispetto ai controlli. S1 è stato riscontrato in diverse regioni del cervello, compresi i canali che collegano il midollo cranico alle meningi (SMC) sia nei topi che negli esseri umani. Ciò suggerisce che, oltre alla distribuzione della proteina S1 attraverso le cellule fagocitiche o lo stravaso diretto dai vasi sanguigni, essa potrebbe utilizzare questi canali come vie di passaggio attraverso il cranio. La proteina S1 si è accumulata nel midollo di tibia e femore e nel midollo spinale.
Utilizzando dati di proteomica umana, gli autori hanno riscontrato una disregolazione di entrambe le cascate del complemento e della coagulazione che coincide con le coagulopatie note in seguito all’iniezione. Le vie legate ai neutrofili sono risultate disregolate, alcune proteine sono risultate upregolate e altre downregolate. Tra le proteine upregolate vi erano quelle associate all’infiammazione, come l’interferone-gamma (IFN-γ) e l’IFN-γ che induceva la proteina C-X-C motif chemokine ligand 10 (CXCL10). Altre modifiche proteiche sono state coinvolte nella formazione delle trappole extracellulari dei neutrofili (NETosis), nella degranulazione dei neutrofili e nelle vie della fosfatidilinositolo 3-chinasi/proteina chinasi B (PI3K-AKT). Nelle meningi, le proteine upregolate sono state associate all’attivazione, alla segnalazione e all’aggregazione delle piastrine.
Nella corteccia cerebrale sono stati riscontrati livelli alterati di proteine ribosomiali e disregolazione delle vie di neurodegenerazione. I livelli di citochine plasmatiche e di IL-6 plasmatica sono aumentati tre giorni dopo l’iniezione del picco S1.
Oltre a iniettare sperimentalmente nei topi l’unità S1 della proteina spike, i ricercatori hanno effettuato l’autopsia di 34 pazienti deceduti per malattie non legate alla COVID-19 e hanno scoperto che 10 di loro avevano proteine spike persistenti nel cranio e hanno notato che queste potrebbero essere coinvolte nei sintomi della COVID di lunga durata attraverso la loro diffusione nel parenchima cerebrale attraverso le meningi. In sintesi, la proteina spike si accumula in varie regioni del cervello, vi persiste anche dopo la morte e causa l’attivazione della microglia, il blocco dell’α7 nAChR e la disregolazione delle vie legate alla coagulazione e ai neutrofili, nonché l’aumento delle proteine infiammatorie, tutti fattori collegati alla perdita di memoria, all’infiammazione del cervello e alla morte cellulare [173].
L’infezione virale da SARS-CoV-2, soprattutto le varianti più precoci, può causare la perdita dell’olfatto e quindi mostra neurotossicità per il nervo olfattivo. I meccanismi dell’azione neurotossica del virus e dei vaccini COVID-19 basati sul gene sono oggetto di ricerche in corso.
Olajide et al. [174] hanno proposto che la glicoproteina spike del SARS-CoV-2 induca la neuroinfiammazione attraverso i suoi effetti sulla microglia:
“L’induzione della neuroinfiammazione da parte di questa proteina nella microglia è mediata attraverso l’attivazione di NF-κB e p38 MAPK, probabilmente come risultato dell’attivazione del TLR4″.
“L’attivazione della microglia BV-2 da parte di S1 ha determinato un aumento del rilascio di TNF-α, IL-6 e IL-1β, che sono segni distintivi della neuroinfiammazione. L’attivazione dei processi neuroinfiammatori da parte della proteina spike S1 è stata ulteriormente confermata dai risultati che hanno mostrato un aumento della produzione di NO mediata da iNOS nella microglia. Un’elevata produzione di iNOS/NO è stata precedentemente collegata a un’ampia gamma di disturbi del sistema nervoso centrale, tra cui il morbo di Alzheimer, il morbo di Parkinson, la sclerosi multipla, l’epilessia e l’emicrania”.
[174] (p. 452-453)
In un esperimento di coltura cellulare in vitro, la proteina spike è stata implicata nell’aumento dell’espressione dell’alfa-sinucleina (α-Syn), una proteina soggetta ad aggregazione che è ulteriormente implicata nella patogenesi dei corpi di Lewy, lesioni caratteristiche nel cervello di pazienti con malattia di Parkinson, demenza a corpi di Lewy e altre malattie neurodegenerative [175].
Winkler et al. [176] hanno causato una lieve COVID-19 respiratoria in un modello murino che esprime ACE-2 umano nella trachea e nel polmone mediante esposizione al SARS-CoV-2 per via intranasale. Non hanno rilevato la presenza di SARSCoV-2 nel cervello, ma hanno trovato segni di neuroinfiammazione e livelli elevati di chemochine nel liquido cerebrospinale e nel siero. Questi cambiamenti hanno portato all’attivazione della microglia nelle regioni della materia bianca sottocorticale e ippocampale. Le microglia sono comunemente chiamate macrofagi del sistema nervoso centrale e mantengono le reti neuronali rimuovendo le spine dendritiche e le sinapsi durante lo sviluppo neuronale. Tuttavia, quando sono state attivate nel modello murino, sono passate a uno stato neurotossico che, nella materia bianca sottocorticale, ha portato alla perdita di precursori oligodendrocitari e di oligodendrociti maturi.
Inoltre, la mielina e gli assoni mielinizzati sono diminuiti per almeno 7 settimane dopo l’infezione, con un impatto sulla struttura e sulla funzione delle reti neuronali. Le malattie demielinizzanti sono alcuni degli effetti negativi noti delle iniezioni di mRNA. Nell’ippocampo, l’attivazione della microglia è stata associata a un’inibizione della neurogenesi, che potrebbe spiegare la formazione di memoria compromessa nei pazienti. L’attivazione della microglia sembrava essere mediata da livelli persistentemente elevati di una molecola chiamata chemochina 11 con motivo C-C (CCL11). La CCL11 è stata associata all’invecchiamento e all’inibizione della neurogenesi [177,178], nonché alle allergie e al reclutamento di eosinofili [179].
Fernández-Castañeda et al. [180] hanno studiato gli effetti di una lieve infezione respiratoria da SARS-CoV-2 in un modello murino. Hanno rilevato cambiamenti nelle citochine e chemochine neuroinfiammatorie, compresa la proteina CCL11 nel liquido cerebrospinale e nel siero per un periodo di 7 settimane dopo l’inizio dell’infezione. Hanno inoltre osservato cambiamenti specifici nelle regioni cerebrali della sostanza bianca sottocorticale, con attivazione della microglia e conseguente perdita di oligodendrociti, cellule oligodendrocitarie-precursori e mielina.
Altri autori hanno riscontrato che la proteina CCL11 aumenta la proporzione di cellule Treg CD4 + CD25 + Foxp3+, l’espressione di CCR3 e Foxp3 e il rilascio di IL2 e TGFβ1 nelle cellule T CD4+ non associate al tumore attraverso la via di segnalazione STAT5 [60]. Le cellule T regolatorie sono immunosoppressive e spostano la risposta immunitaria verso la tolleranza immunitaria. Questo concorda con un gruppo tedesco [149] che ha dimostrato che la vaccinazione con complessi mRNA-LNP causa uno spostamento generale degli anticorpi dalle IgG1 e IgG3 infiammatorie alle IgG4, che è associato alle cellule Treg e alla tolleranza immunitaria e si verifica dopo la seconda vaccinazione. La percentuale di anticorpi IgG specifici per il picco che erano IgG4 è aumentata dallo 0,04% poco dopo la seconda dose al 19,27% dopo la terza dose di vaccino. A dimostrazione dell’effetto tolleranza, un ampio studio della Cleveland Clinic sul personale ha rilevato che l’aumento delle IgG4 con le successive dosi di richiamo è correlato a una maggiore suscettibilità all’infezione da SARS-CoV-2 [181].
Le chemochine, come l’eotassina CCL11 (eotaxina-1), sono prodotte localmente da cellule epiteliali, mesenchimali ed endoteliali e sono fondamentali per dirigere la migrazione e il priming degli eosinofili o la secrezione di mediatori una volta che questi raggiungono le vie aeree [182,183]. Gli eosinofili secernono una serie di proteine basiche del granulo proinfiammatorie che includono la proteina basica maggiore, la proteina cationica eosinofila, la neurotossina derivata dagli eosinofili e la perossidasi degli eosinofili [184].
Un altro studio ha esaminato il dominio tossina-simile della RBG su S1, che si lega al nAChR α7, aumentando i livelli di IL-1b e TNFα nel cervello e compromettendo la memoria episodica nei topi [178]. Come discusso in precedenza, il blocco di questo recettore con la proteina spike potrebbe causare livelli molto elevati di infiammazione, poiché regola la produzione di citochine pro-infiammatorie.
Il nAChR è altamente espresso nell’ippocampo, nella corteccia e in diverse regioni limbiche ed è coinvolto nella cognizione, nell’elaborazione delle informazioni sensoriali, nell’attenzione, nella memoria di lavoro e nelle vie della ricompensa. Nei pazienti affetti da malattia di Alzheimer è stata segnalata una riduzione di α7 nel cervello, in particolare nell’ippocampo. Oltre a legare il nACHR α7 in modo simile a una neurotossina, è stato dimostrato che la proteina spike è amiloidogenica [185]. È noto che i peptidi amiloidi β (Aβ) della malattia di Alzheimer si legano ai nAChR con affinità picomolare e che le α-neurotossine di serpente li inibiscono in modo competitivo [186]. È noto da tempo che l’amiloide si lega ai recettori nAChR, così come la proteina spike.
La modellazione computerizzata in silico del meccanismo di legame con l’amiloide dimostra una somiglianza con quello del veleno di serpente e quindi è stato proposto che l’interazione con l’AChR consenta un cambiamento conformazionale dell’amiloide tale da bloccare l’apertura del canale e, analogamente al veleno di serpente, a basse concentrazioni inizialmente attiva, ma poi rallenta e blocca la funzione del canale AChR. Le basse concentrazioni (picomolari) di peptidi Aβ solubili nel cervello di persone sane svolgono un ruolo fisiologico, mentre nella malattia di Alzheimer le concentrazioni aumentano fino a raggiungere le nanomoli e innescano la formazione di placche insolubili, uno dei principali segni neuropatologici dell’Alzheimer [187].
7.3.2. Formazione di prioni ed effetti neurodegenerativi
Le malattie neurodegenerative come l’Alzheimer, il morbo di Parkinson e la sclerosi laterale amiotrofica (SLA) sono tutte associate a proteine mal ripiegate che si accumulano in placche e corpi di Lewy. Queste proteine, definite amiloidogeniche, sono state anche definite “prioniche”. Il dominio C-terminale prionico della TDP-43 e l’α-sinucleina interagiscono sinergicamente per generare fibrille ibride neurotossiche [188]. Esistono quindi almeno due meccanismi con cui la proteina spike, attraverso il nAChR α7, può contribuire ai disturbi neurodegenerativi: l’inibizione diretta e l’inibizione secondaria dell’amiloidogenesi.
Il dominio di legame al recettore della proteina spike della SARS-CoV-2 ha proprietà prioniche, è l’unico coronavirus con tali proprietà e presenta una maggiore affinità di legame del virione al recettore ACE-2 e quindi una maggiore infettività e trasmissibilità umana [189]. La proteina spike completa con la subunità S1 del dominio di legame del recettore (RBD) intatta, se attraversa la BBB, ha quindi proprietà prioniche che giustificano ulteriori ricerche su possibili effetti patogeni.
Inoltre, i vaccini a base di mRNA o adenovettoreDNA includono sequenze proteiche che possono indurre TDP-43 e FUS (proteine coinvolte nel legame RNA/DNA e nella regolazione dell’RNA) ad aggregarsi in una configurazione prionica. Questo potrebbe potenzialmente portare a condizioni neurodegenerative, come la malattia di Alzheimer [190,191]. Il collegamento con la malattia neurodegenerativa è la capacità della proteina spike di interagire con le proteine che legano l’eparina e formano l’amiloide [192]. Sebbene speculative, queste considerazioni sono supportate da un caso di malattia da prioni dovuto alla vaccinazione [193]. In un esperimento in vitro, la proteina spike è stata proteolata in segmenti più piccoli dall’elastasi neutrofila, alcuni dei quali hanno mostrato proprietà amiloidogeniche [185].
Alcune sequenze primarie nelle sialoglicoproteine presenti nei neuroni del cervello consentono a queste proteine di adottare una serie di strutture alternative in grado di auto-replicarsi a livello conformazionale attraverso copie templanti della stessa proteina. Questa conversione in ciò che viene definito prione altera tipicamente in modo radicale la funzione della proteina, diventando spesso trasmissibile [194]. I prioni consistono quindi nell’isoforma mal ripiegata e amiloidogenica della proteina prionica.
Le malattie da prioni, come la malattia di Creutzfeldt-Jakob (CJD), sono disturbi neurodegenerativi fatali causati da vacuolizzazione e cambiamenti neuropatologici spongiformi con rapida neurodegenerazione e attivazione di astrociti e microglia [195]. L’accumulo neuronale di proteine mal ripiegate è coinvolto nella patogenesi di altri disturbi neurodegenerativi, tra cui la malattia di Alzheimer e il morbo di Parkinson [196,197]. Anche le malattie infettive da prioni possono indurre effetti neurocognitivi aspecifici [198].
Sono stati documentati anche casi di CJD dopo la vaccinazione con il vaccino COVID-19; uno già a 5 giorni dal vaccino [199] e un altro morto a 6 mesi [200]. In Australia i decessi per demenza nel periodo gennaio-febbraio 2022 sono aumentati del 27,2% rispetto al periodo di riferimento 2017-2021 (che comprendeva la prima ondata di COVID-19) per gli stessi mesi, con un tasso di mortalità per demenza in continuo aumento da allora [201,202].
I sintomi neurologici sono comunemente osservati dopo la vaccinazione COVID-19, in “Covid lungo” e dopo la vaccinazione con mRNA, sollevando la possibilità di un coinvolgimento dei prioni.
I potenziali meccanismi attraverso i quali la vaccinazione con mRNA COVID-19 potrebbe produrre prioni e innescare processi neurodegenerativi includono: Le proteine che legano l’RNA, come la TAR DNA binding protein (TDP-43) e la Fused in Sarcoma (FUS), possono essere attivate per formare prioni che causano la malattia; i dimeri della TDP-43 legano RNA ricco di UG o DNA ricco di TG e sono resistenti alla degradazione [203] e il legame con queste sequenze di RNA quando le proteine sono citoplasmatiche può causare un misfolding che porta alla formazione di prioni [204]. È quindi preoccupante che il vaccino Pfizer utilizzi un unico nucleoside dell’RNA, l’1-metil-3′-pseudouridil (Ψ), e che siano stati trovati molteplici motivi uracili nell’mRNA del vaccino [191].
Oltre alle sequenze di uracile nell’mRNA che possono legare le proteine e precipitare il misfolding, sono stati identificati in silico domini prion-like nella RBD della subunità S1 della proteina spike. Il SARS-CoV-2 è l’unico coronavirus con tale dominio, che conferisce un’affinità per il recettore ACE-2 da 10 a 20 volte superiore rispetto al SARS-CoV-1, oltre al suo potenziale prionico [189].
Inoltre, la proteina spike RBD ha diversi siti di legame con l’eparina che possono interagire con l’eparina e con le proteine che formano l’amiloide, suggerendo che questo peptide è incline ad agire come amiloide funzionale e a formare aggregati tossici [205]. È stato dimostrato che la proteina S1 si lega in modo stabile alle proteine Aβ, α-sinucleina, tau, prioni e TDP-43, inclini all’aggregazione, e potrebbe quindi avviare l’aggregazione di queste proteine e la conseguente neurodegenerazione [192].
I ricercatori hanno anche identificato un motivo “glycine zipper” all’interno della subunità S1 legato alla suscettibilità al misfolding e quindi alla formazione di prioni. Il motivo GxxxG è una caratteristica comune delle proteine transmembrana e le glicine svolgono un ruolo essenziale nella reticolazione delle α-eliche della proteina [206]. Le proteine prioniche diventano tossiche quando le α-eliche si ripiegano male come foglietti β e la proteina non è in grado di entrare nella membrana [207]. La proteina precursore dell’amiloide-β (APP) ha quattro motivi GxxxG: la glicina svolge un ruolo centrale nel misfolding dell’amiloide-β legato alla malattia di Alzheimer [208]. La proteina spike del SARS-CoV-2 è una proteina transmembrana che contiene cinque motivi GxxxG nella sua sequenza (vedi uniprot.org/uniprot/P0DTC2), uno dei quali all’interno della RBD, ed è quindi plausibile che possa comportarsi come un prione [209].
Un altro meccanismo proposto è l’induzione spontanea di prioni e proteine prioniche attraverso gli effetti delle specie reattive dell’ossigeno (ROS). L’eccesso di formazione di ROS e la presunta compromissione della funzione mitocondriale con disfunzione cognitiva è una caratteristica sia della COVID-19 acuta grave, sia della COVID lunga [198] e della spikeopatia. In situazioni di stress, TDP-43, FUS e altre proteine che legano l’RNA traslocano dal nucleo al citoplasma e si associano ai granuli dello stress [210,211].
Quando lo stress si dissipa, i granuli di stress si disaggregano e le proteine che legano l’RNA ritornano al nucleo. Un maggiore stress ambientale con eccesso di ROS (ad esempio, esposizione a tossine, lesioni traumatiche, infezioni virali) potrebbe causare la perdita del funzionamento normativo del proteosoma e il ripristino della normale conformazione, aumentando la probabilità che le proteine che legano l’RNA si aggreghino in modo inappropriato [212,213].
Simile è l’effetto della neuroinfiammazione, in particolare dell’attivazione degli astrociti. Gli studi sugli animali dimostrano la transizione accelerata dagli stadi preclinici a quelli clinici della malattia da prioni in caso di coinfezione, con neuroinfiammazione, aumento delle citochine pro-infiammatorie e maggiore attivazione degli astrociti reattivi A1 [214]. Il TNF e il C1q della microglia attivata attivano ulteriormente gli astrociti A1 [215], che si ritiene siano neurotossici in quanto mediano il danno neuronale e fungono da focolai per la propagazione dei prioni [216]. È stato inoltre dimostrato che gli anticorpi non neutralizzanti dopo la vaccinazione contro i peptidi della proteina spike nei topi attivano le cellule gliali e gli astrociti [217], coerentemente con il meccanismo proposto di astrociti attivati, formazione di prioni e disfunzione cognitiva.
Seneff e colleghi, in un’ampia rassegna dei potenziali meccanismi fisiopatologici della proteina spike nelle malattie neurodegenerative, descrivono “il contributo della proteina spike, attraverso le sue proprietà prioniche, alla neuroinfiammazione e alle malattie neurodegenerative; ai disturbi della coagulazione all’interno dei vasi; all’ulteriore rischio di malattia dovuto alla soppressione della regolazione della proteina prionica nel contesto dell’insulino-resistenza ampiamente diffusa” e “spiegano perché queste caratteristiche prioniche sono più rilevanti per le proteine spike indotte dall’mRNA del vaccino che per l’infezione naturale con il SARS-CoV-2” [29] (abstract pag. 1 ).
Tra i risultati principali esaminati vi sono:
L’endoteliite indotta da spike disturba la barriera emato-encefalica e aggrava la malattia di Alzheimer attraverso l’interazione della proteina spike con l’amiloide β o la tau iperfosforilata [164].
Alcuni studi hanno dimostrato che gli autoanticorpi nel dominio globulare C-terminale possono causare una forma aggressiva della malattia di Creutzfeldt Jakob (CJD) interferendo con il trasporto della proteina prionica nel reticolo endoplasmatico [218].
La stessa proteina spike, che è anche una proteina che lega l’RNA, può facilitare la trascrizione inversa dell’mRNA della proteina spike nel DNA, mediata da LINE-1. I neuroni esprimono attivamente LINE-1 in associazione alle malattie neurodegenerative [219,220].
Le cellule che assumono l’mRNA dalle nanoparticelle lipidiche nei vaccini a base di mRNA impacchettano alcuni degli mRNA, insieme ai lipidi cationici ionizzabili, in piccole particelle lipidiche rilasciate come esosomi che possono essere trasportate in tutto il corpo [59,221]. Ad esempio, una cellula immunitaria nella milza potrebbe trasportare il codice mRNA intatto per la proteina spike al cervello lungo il nervo vago, dove un neurone o una cellula microgliale potrebbero iniziare a sintetizzare la proteina spike.
I microRNA (miRNA) sono piccoli frammenti di codice RNA attivo, in grado di controllare attivamente le funzioni cellulari, tra cui l’embriogenesi e l’apoptosi. Il miR-146a si trova negli esosomi rilasciati dalle cellule immunitarie e fa parte dell’elenco dei miRNA i cui livelli di espressione sono alterati in associazione alla COVID-19 [222]. Gli esosomi che raggiungono il tronco encefalico trasportano non solo la proteina spike, ma potenzialmente anche mRNA intatto e molecole di miRNA, tra cui il miR-146a che è associato sia alle infezioni virali che alle malattie da prioni nel cervello [223,224].
La stessa proteina spike induce una forte upregolazione del TNF-α e causa problemi cognitivi, il che potrebbe indicare che upregola l’espressione della proteina prionica (PrP) nel cervello. Un aumento del numero di glicoproteine prioniche (PrPC) può portare al misfolding della conformazione prionica e generare prioni e malattie correlate ai prioni [225,226].
È stato dimostrato che la proteina Spike induce la senescenza nelle cellule trasfettate [227]. Inoltre, è stato proposto che i vaccini a base di mRNA COVID-19 possano indurre la senescenza precoce attraverso la formazione di sincizi nelle cellule immunitarie esposte, principalmente a causa del loro contenuto lipidico (lipidi ionizzabili, colesterolo e il fosfolipide 1,2-distearoil-sn-glicero-3-fosfocolina (DSPC)). [228]. Studi molecolari in vitro dimostrano che l’affollamento macromolecolare può facilitare la conversione della PrP nativa nella configurazione neurotossica dell’oligomero β solubile [229].
7.3.3. Disautonomia
Un’altra caratteristica fondamentale dell’infezione o della vaccinazione COVID-19 è la disautonomia (DSN), un disturbo neurologico della funzione del sistema nervoso autonomo (ANS), con effetti diffusi su cuore, vescica, ghiandole sudoripare, pupille, intestino e altri sistemi autonomici. Sono colpiti sia il sistema nervoso simpatico (SNS) che quello parasimpatico (PSNS), con il potenziale di una tempesta simpatica e di risposte autonomiche anomale che includono sudorazione eccessiva, intolleranza all’esercizio fisico, insonnia, tachicardia a riposo, ipotensione posturale, affaticamento, disfunzioni urinarie e intestinali. La natura neuroinvasiva della SARS-CoV-2 provoca complicazioni neurologiche come la DSN [96] e suggerisce un danno diretto ai neuroni autonomi o meccanismi indiretti immuno-mediati, come avverrebbe con l’inibizione del nAChR α7. L’inibizione del nAChR da parte del SARS-CoV-2 può portare all’inibizione del PSNS e all’esagerazione del SNS con conseguente progressione della tempesta di citochine [94].
Un’altra disfunzione neurologica correlata alla COVID-19 è l’anosmia, un sintomo comune della COVID-19 e prodromico della malattia di Parkinson. Il bulbo olfattivo ha una ricca rete di nAChR e i nAChR α7 possono essere espressi anche sui terminali degli assoni olfattivi. Ciò potrebbe facilitare l’infezione del SNC attraverso il trasporto anterogrado lungo il nervo olfattivo. L’anosmia può quindi rappresentare un altro segno di disfunzione del sistema colinergico nicotinico in COVID-19 [32].
Questi potenziali effetti neuropatologici sono fonte di gravi preoccupazioni, data la natura sperimentale dei vaccini a mRNA, la patogenicità della proteina spike della SARS-CoV-2 e la capacità della matrice di trasporto lipido-nanoparticellare di attraversare la BBB.
7.4. Effetti cancerogeni
Ad oggi, non esistono prove conclusive che colleghino le iniezioni di mRNA al cancro. Esistono prove aneddotiche di giornali e medici di tutto il mondo che riportano la riattivazione di tumori dopo anni di remissione. Questi sono stati definiti i cosiddetti “turbo-cancro”, che progrediscono rapidamente fino a stadi avanzati o alla morte. Un eminente oncologo che ha condotto ricerche sul potenziale antitumorale dei vaccini [230], il Prof. Angus Dalgleish, si è attirato critiche severe per le affermazioni secondo cui ciò si verifica dopo i vaccini COVID-19. Dalgleish ha scritto una lettera al redattore capo del BMJ, che ha trasformato in una lettera aperta [231].

È troppo presto per fare una valutazione definitiva; tuttavia, possiamo considerare la proteina spike e il suo potenziale di causare il cancro o di compromettere il sistema immunitario al punto da non poterlo combattere efficacemente. Nella sua lettera, Dalgleish ha osservato che la maggior parte delle segnalazioni relative al vaccino post-COVID-19 riguardava “melanomi o tumori basati sulle cellule B, che sono molto suscettibili al controllo immunitario”.
La risposta immunitaria comporta l’attivazione di una rete molto complessa di vie di attivazione e inibizione. La difesa immunitaria coesiste con il mantenimento dell’auto-tolleranza e l’equilibrio tra questi processi è fondamentale. I checkpoint immunitari svolgono un ruolo importante nel controllo della rete. Un importante recettore di checkpoint inibitorio è la proteina 1 della morte cellulare programmata (PD-1, CD279), che si trova tipicamente sulle cellule T, sulle cellule B mature e su altre cellule immunitarie [232]. I suoi ligandi, il ligando della morte programmata 1 (PD-L1) e PD-L2, sono regolarmente espressi sulle cellule che presentano l’antigene, come le cellule dendritiche e i macrofagi; l’upregulation di PD-L1 si osserva dopo l’attivazione di monociti e granulociti [233,234].
In questo contesto, Loacker et al. [235] dimostrano che l’espressione di PD-L1 nei granulociti e monociti periferici di individui vaccinati è significativamente più alta rispetto a quella dei non vaccinati. Diskin et al. [236] hanno scoperto che l’espressione di PD-L1 da parte delle cellule T nel cancro è regolata dall’antigene tumorale e da spunti infiammatori sterili. Le cellule T PD-L1+ esercitano una tolleranza che promuove il tumore [232] attraverso (1) il legame di PD-L1 induce un “back-signalling” dipendente da STAT3 (proteina 3 di trasduzione e attivazione del segnale di trascrizione) nelle cellule T CD4+, che ne impedisce l’attivazione [233]; (2) le cellule T PD-L1+ limitano le cellule T effettrici e accelerano la tumorigenesi, anche in assenza di PD-L1 endogeno e (3) le cellule T PD-L1+ coinvolgono i macrofagi PD-1+ [234], inducendo un programma alternativo M2-like, che ha effetti paralizzanti sull’immunità antitumorale adattativa. Nel complesso, questi studi dimostrano che le cellule T PD-L1+ guidano la tolleranza sull’immunità tumorale.
Inoltre, Singh e Singh [87] hanno dimostrato in vitro l’interazione tra la subunità S2 della proteina spike con le proteine soppressorie dei tumori P53 e BRCA1 e BRCA2. Oltre all’interazione diretta, la trasfezione di cellule con il codice dell’mRNA della proteina spike determina la generazione di esosomi contenenti miRNA (miR-148 e miR-590), che sopprimono la produzione del fattore regolatore dell’interferone 9 (IRF9) e attivano trascrizioni di geni pro-infiammatori [237].
È dimostrato che la vaccinazione con Covid19 ostacola la segnalazione dell’interferone di tipo I [238], che è fondamentale per un sistema immunitario sano. L’interferone è coinvolto nell’inibizione delle cellule tumorali e nella regolazione della sintesi proteica nelle cellule immunitarie e la sua compromissione è legata al cancro e alle malattie virali. L’inibizione in corso di IRF9 sopprime il ligando di induzione dell’apoptosi legato al TNF (TRAIL) e tutti i suoi effetti regolatori e apoptotici. Si prevede che la soppressione di IRF9 comprometta anche gli effetti antitumorali di BRCA2 e si è scoperto che promuove una potente risposta immunoinfiammatoria associata a malattie neurologiche letali [239]. Le carenze di IRF9 comportano un rischio significativamente maggiore di gravi malattie COVID-19 [240] e compromettono gli effetti antitumorali dell’attività del gene BRCA2.
I tumori associati comprendono il cancro al seno, alle tube di Falloppio e alle ovaie per le donne, il cancro alla prostata e al seno per gli uomini e la leucemia mieloide acuta nei bambini. Liu et al. [241] hanno dimostrato che le iniezioni di mRNA sopprimono anche IRF7 e STAT2 (proteina 2 di trasduzione e attivazione del segnale di trascrizione), il che può interferire con gli effetti antitumorali del gene di suscettibilità mammaria 1 (BRCA1). I tumori associati a BRCA1 sono il cancro al seno, all’utero e alle ovaie nelle donne, il cancro alla prostata e al seno negli uomini, un rischio moderatamente aumentato per il cancro al pancreas in entrambi e la leucemia mieloide acuta nei bambini [242]. Una ridotta espressione di BRCA1 è legata sia al cancro che alla neurodegenerazione.
7.5. Evidenze bioptiche e autoptiche di spikeopatia
Una serie di casi tedeschi multisito di 15 sospetti casi di miocardite post vaccino COVID-19 (otto Pfizer, due AstraZeneca, due Johnson & Johnson) ha eseguito un esame immunoistopatologico completo delle biopsie endomiocardiche (EMB). I test immunologici per precedenti SARS-CoV-2 o altri virus associati all’infiammazione del miocardio sono risultati negativi. Tutti i pazienti, tranne uno, presentavano biomarcatori infiammatori e diagnosi di cardiomiopatia infiammatoria, miocardite attiva e miocardite grave a cellule giganti. Nove dei 14 pazienti sono risultati positivi alla proteina spike intramiocardica. Quando sono stati esaminati gli infiltrati linfocitari, la preponderanza di cellule T CD4+ rispetto a CD8+ ha portato gli autori a concludere che una reazione autoimmune fosse alla base della patologia [103]. Analogamente, la frequenza relativa dei linfociti attivati da HLA-D4 e dei macrofagi MAC-1+ è stata presa a sostegno di questa conclusione. La Figura 7 rappresenta alcune delle colorazioni tissutali delle proteine di punta [103].
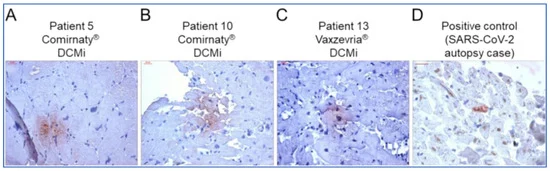
Figura 7. A. Evidenza della proteina SARS-CoV-2 spike nel tessuto cardiaco dopo la vaccinazione COVID-19. (A-C) Colorazioni immunoistochimiche rappresentative della proteina spike SARS-CoV-2 in EMB di pazienti con diagnosi di DCMi dopo aver ricevuto Comirnaty® (pannelli (A,B), pazienti 5 e 10) o Vaxzevria® (pannello (C), paziente 13). (D) Il tessuto cardiaco positivo al SARS-CoV-2 è servito come controllo positivo. Ingrandimento 400×. Barre di scala 20 μm. Ristampato con il permesso di Ref. [103]. Copyright 2022 MDPI.
Un caso autoptico di un uomo di 76 anni ha rivelato che le proteine spike del vaccino COVID-19 sono state la causa del decesso [167]. Clinicamente questo soggetto ha avuto effetti avversi cardiovascolari dal giorno della sua prima vaccinazione (AstraZeneca) nel maggio 2021, e cambiamenti neurologici e psichiatrici dopo la sua seconda vaccinazione (Pfizer) nel luglio 2021, poi è collassato ed è morto 3 settimane dopo il suo richiamo (Pfizer) nel dicembre 2021. Cambiamenti infiammatori acuti e cronici e degenerazioni cellulari hanno colpito il cervello e il cuore. Le colorazioni immunoistochimiche hanno mostrato la proteina spike nelle pareti dei vasi sanguigni, nelle cellule gliali del cervello e nelle “cellule endoteliali cardiache che mostravano una miocardite linfocitaria” [167] (pag. 8). Inoltre, “la colorazione immunoistochimica non ha rilevato la proteina nucleocapside del SARS-CoV-2”, tanto che l’autore ha concluso che: “la presenza della proteina spike deve essere attribuita alla vaccinazione piuttosto che all’infezione virale” [167] .
Una serie di casi di 13 autopsie cerebrali negli Stati Uniti ha rilevato che la subunità S1 (comprensiva del dominio di legame al recettore RBD) della proteina spike ha causato la degenerazione delle cellule endoteliali neurovascolari con endoteliite, rilascio di citochine e danni ai capillari neurali. Le cellule endoteliali contenevano la glicoproteina spike ma non l’RNA virale, confermando così che la subunità S1/RBD della proteina spike libera è il principale agente patogeno in questi casi di malattia COVID-19, come mostrato nella Figura 8 [243].
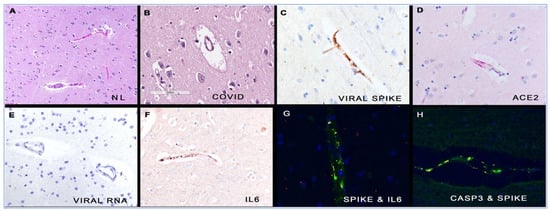
Figura 8. Correlati istologici e molecolari di COVID-19 nel cervello umano. Il pannello (A) mostra i microvasi del cervello normale. In confronto, molti dei capillari nei tessuti cerebrali COVID-19 mostrano un marcato edema perivascolare (pannello (B)). Le analisi delle sezioni seriali del cervello COVID-19 mostrano che le cellule endoteliali dei microvasi contenevano la glicoproteina spike (pannello (C)), il recettore ACE2 (pannello (D)) e l’IL 6 (pannello (F)), ma non l’RNA virale (pannello (E)). Il segnale giallo fluorescente indica la co-localizzazione della proteina spike con IL6 (pannello (G)) e la caspasi 3 (pannello (H)), rispettivamente, in queste cellule endoteliali. Ogni ingrandimento è 800× con segnale DAB (marrone) (pannelli (C-F)) o Fast Red (rosso) (pannello D). (Per l’interpretazione dei riferimenti ai colori nella legenda di questa figura, si rimanda il lettore alla versione web di questo articolo). Ristampato da Annals of Diagnostic Pathology, Vol. 51, Nuovo GJ, Magro C, Shaffer T. et al., Endothelial cell damage is the central part of COVID-19 and a mouse model induced by injection of the S1 subunit of the spike protein. Figura 1, 151682, Ristampato con autorizzazione da Ref. [243]. Copyright (2020) Elsevier.
Lo stesso gruppo di ricerca ha riscontrato risultati simili in una serie di 11 autopsie di cuori di pazienti deceduti a causa della COVID-19 [244]. Hanno rilevato i seguenti dettagli, con la forte implicazione che l’espressione dell’antigene spike estraneo fosse patologicamente significativa:
“La malattia cardiaca nella COVID-19 fatale è associata alla proteina spike virale, ma non al virus infettivo. La proteina spike virale viene endocitata nei macrofagi interstiziali e induce miocardite. I reperti istologici mostrano edema perivascolare, danno alle cellule endoteliali e microtrombi”.
[244] (evidenziazione, pag. 1)
I risultati di questo gruppo di ricerca statunitense confermano la spikeopatia come meccanismo patogenetico per la patologia neurovascolare e cardiaca di COVID-19. Pertanto, i geni ampiamente biodistribuiti che codificano per la produzione prolungata di proteine spike nel cervello e nel cuore attraverso i vaccini COVID-19 seguirebbero probabilmente gli stessi meccanismi d’azione.
Un caso di autopsia su una recluta militare di 22 anni, precedentemente sana, in Corea del Sud, ha rivelato un’estesa miocardite cinque giorni dopo la vaccinazione con mRNA COVID-19 di Pfizer. Gli autori hanno sottolineato l’importanza di condurre indagini istopatologiche durante le autopsie. Hanno notato una marcata carenza di tali indagini nella letteratura accademica durante la pandemia COVID-19 [245].
I patologi tedeschi hanno eseguito una serie di autopsie sui corpi di persone decedute poco dopo la vaccinazione e che non avevano avuto in precedenza la malattia da COVID-19. Il capo patologo di Heidelberg, il dottor Schirmacher e colleghi, hanno eseguito l’autopsia su 35 persone decedute in casa entro due settimane dalla vaccinazione contro l’mRNA COVID-19. Dieci di esse sono risultate decedute per una malattia precedente alla vaccinazione.
Dieci sono risultati morti per malattie preesistenti. Dei restanti 25 decessi inattesi, cinque sono stati riscontrati per miocardite, con infiltrati infiammatori linfocitari del miocardio e presunta aritmia associata, in assenza di altre patologie cardiovascolari significative. Tutti e cinque sono morti entro una settimana, uno entro 12 ore dalla vaccinazione. Un caso presentava un infiltrato infiammatorio simile nel sito di iniezione del muscolo deltoide [246].
Un altro gruppo di patologi tedeschi, guidato dal Prof. Arne Burkhardt e dal collega Prof. Walter Lang, ha presentato i risultati istopatologici di una serie di 25 autopsie dopo la vaccinazione con mRNA COVID-19 di Pfizer. Questi risultati includevano proteine spike prodotte dal vaccino in lesioni dei vasi sanguigni e in infiltrati infiammatori nella miocardite. La Figura 9 è tratta da una presentazione PowerPoint di una conferenza in lingua tedesca che descrive le proteine spike prodotte dall’mRNA macchiate a livello immunoistopatologico [247] e mostra le proteine spike colorate (in marrone) che infiltrano le cellule endoteliali della parete di un vaso sanguigno:
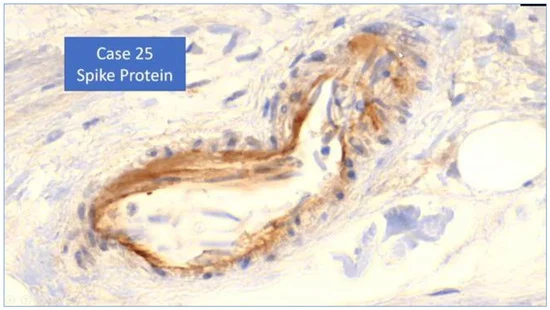
Figura 9. Proteina Spike nella parete dei vasi sanguigni da Burkhardt (2022a) [247].
La traduzione dal tedesco che accompagna questa diapositiva, nelle parole del Prof. Arne Burkhardt, è:
“Sì, questo è il risultato che siamo stati in grado di raccogliere utilizzando metodi speciali. Ciò significa che siamo effettivamente certi che, in questo caso, possiamo ancora rilevare questa tossina nelle pareti vasali 122 giorni dopo la vaccinazione. È anche chiaro che si tratta del fattore causale di questo danno.
Quello che non mi è chiaro al momento è se sia solo depositata lì o se queste cellule producano effettivamente la proteina spike, come viene detto loro di fare dall’mRNA, per così dire”.
La Figura 10 è tratta dalla stessa serie di casi autoptici di Burkhardt e colleghi, e mostra che la proteina spike ha attraversato la barriera emato-encefalica o che il complesso lipide-nanoparticella-mRNA l’ha fatto e ha causato la trascrizione di proteine spike nel tessuto cerebrale [248].
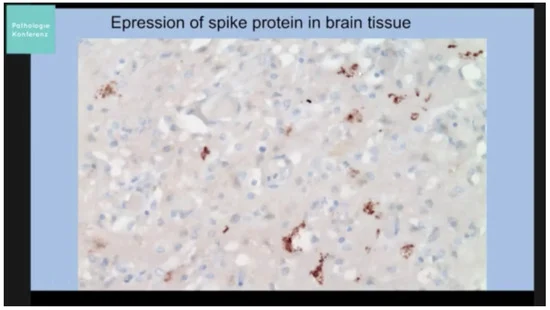
Figura 10. Proteine spike nel tessuto cerebrale di Burkhardt (2022b) [248].
La presenza di proteine spike nel tessuto patologico che ha contribuito alla morte dei pazienti potrebbe essere descritta come analoga al ritrovamento di una “pistola fumante” sulla scena di un crimine, solo che il “colpo” è stato sparato in alcuni casi mesi prima. È chiaro che sono necessarie altre autopsie che utilizzino queste metodologie di colorazione e la relativa ricerca.
Una recente serie di casi di tre autopsie in pazienti deceduti per VITT da vaccini adenovectorDNA di AstraZeneca o Janssen/Johnson & Johnson ha utilizzato la colorazione istopatologica dei trombi del seno venoso cerebrale [7]. Gli autori riferiscono che:
“Le cellule endoteliali adiacenti al trombo erano ampiamente distrutte. I marcatori della trappola extracellulare dei neutrofili e dell’attivazione del complemento erano presenti sul bordo e all’interno dei trombi venosi cerebrali. La proteina SARS-CoV-2 spike è stata rilevata all’interno del trombo e nella parete del vaso adiacente”.
[7]
Il ritrovamento di proteine spike nel sito dei trombi venosi cerebrali dei vaccini COVID-19 con vettore virale e la presenza di NETosi, come descritto sopra, fornisce un’ulteriore prova della spikeopatia da vaccini basati sul gene.
8. Discussione
Abbiamo iniziato questo articolo citando la risposta dell’autorità sanitaria australiana, il TGA, alla domanda di un senatore australiano sui rischi dei vaccini basati sui geni che inducono le cellule umane a produrre la proteina spike della SARS-CoV-2. La risposta è stata che la proteina spike è un elemento che non può essere considerato come una proteina spike. La risposta è stata che la proteina spike non è un agente patogeno. Abbiamo presentato prove significative che la proteina spike è patogena. Questo vale quando è parte del virus, quando è libera ma di origine virale e quando è prodotta nei ribosomi dall’mRNA dei vaccini COVID-19 a mRNA e adenovettoreDNA. I meccanismi fisiopatologici dell’azione della proteina spike continuano a essere chiariti.
Abbiamo stabilito che la proteina spike causa danni legandosi al recettore ACE-2 e quindi downregolando il recettore, danneggiando le cellule endoteliali vascolari. La proteina spike ha un dominio di legame simile a quello di una tossina, che si lega ai nAChR α7 del sistema nervoso centrale e del sistema immunitario, interferendo così con le funzioni dei nAChR, come la funzione di ridurre l’infiammazione e le citochine proinfiammatorie, come l’IL-6. Il legame con le malattie neurodegenerative è anche dovuto alla capacità della proteina spike di interagire con le proteine amiloidi che si legano all’eparina, dando inizio all’aggregazione delle proteine cerebrali.
La persistenza della proteina spike causa un’infiammazione persistente (infiammazione cronica), che potenzialmente può portare il sistema immunitario alla tolleranza immunitaria (IgG4). Un effetto particolare per le donne e la gravidanza è il legame della proteina spike con il recettore alfa degli estrogeni, che interferisce con la messaggistica estrogenica.
La proteina spike è citotossica all’interno delle cellule, interagendo con i geni soppressori del cancro e causando danni mitocondriali. Le proteine spike espresse sulla superficie delle cellule provocano una risposta autoimmune citopatica.
La proteina spike libera si lega all’ACE-2 su altre cellule degli organi e del sangue. Nel sangue la proteina spike influenza le piastrine a rilasciare fattori di coagulazione, a secernere fattori infiammatori e a formare aggregati leucociti-piastrine. La proteina spike lega il fibrinogeno, inducendo la formazione di coaguli di sangue.
Esiste anche una problematica omologia della proteina spike con proteine chiave del sistema immunitario adattativo, che porta all’autoimmunità in caso di vaccinazione con l’mRNA che produce la proteina spike.
I fattori farmacocinetici contribuiscono alla fisiopatologia. Come accennato, lo studio di biodistribuzione di Pfizer (in cui il 75% delle molecole carrier lipido-nanoparticelle ha lasciato il deltoide per tutti gli organi entro 48 ore) per il PMDA giapponese era noto al TGA australiano prima dell’autorizzazione provvisoria dei vaccini COVID-19 a base di mRNA per la popolazione australiana [5]. Poiché provocano la replicazione della proteina spike in molti organi, i vaccini basati sui geni agiscono come virus sintetici.
Il vettore lipidico-nanoparticellare dell’mRNA e il PEG associato, che rende il complesso mRNA-LNP più stabile e resistente alla degradazione, hanno i loro effetti tossici; le lipido-nanoparticelle principalmente attraverso effetti pro-infiammatori e il PEG attraverso l’anafilassi in individui sensibili.
Röltgen et al. [53] hanno riscontrato che l’mRNA stabilizzato con N1-metilpseudouridina nei vaccini COVID-19 produce proteine spike per almeno 60 giorni. Altre ricerche citate sulla retroposizione del codice genetico [249], suggeriscono la possibilità che tale produzione di una proteina patogena estranea possa potenzialmente durare tutta la vita o addirittura essere transgenerazionale.
Un ampio numero di ricerche emergenti dimostra che la stessa proteina spike, in particolare la subunità S1, è patogena e causa l’infiammazione e altre patologie osservate nella COVID-19 acuta grave, probabilmente nella COVID lunga, e nelle lesioni da vaccino mRNA e adenovectorDNA COVID-19. Il termine “spikeopatia” è stato coniato dal ricercatore francese Henrion-Caude [98] in occasione di una conferenza e, dati i vari e sostanziali effetti patologici della proteina spike della SARS-CoV-2, suggeriamo che l’uso del termine abbia un valore euristico.
La spikeopatia esercita i suoi effetti, come riassunto da Cosentino e Marino [86], attraverso il legame con l’ACE-2, che provoca aggregazione piastrinica, trombosi e infiammazione; l’alterazione delle glicoproteine transmembrana CD147, che interferiscono con la funzione dei periciti cardiaci e degli eritrociti; il legame con i TLR2 e TLR4, che scatena cascate infiammatorie; il legame con l’ER alfa, che potrebbe essere responsabile di irregolarità mestruali, e l’aumento del rischio di cancro attraverso le interazioni con p53BP1 e BRCA1. Altre ricerche mostrano ulteriori effetti spikeo-patologici attraverso la produzione di citochine infiammatorie indotta dall’ACE-2, la fosforilazione di MEK e la downregulation di eNOS, che compromettono la funzione delle cellule endoteliali.
Gli effetti particolarmente nuovi della proteina spike coinvolgono la disfunzione del sistema colinergico nicotinico attraverso l’inibizione dell’α7 nAChR, con conseguente compromissione delle vie biochimiche antinfiammatorie in molte cellule e sistemi di organi, nonché un’alterazione del tono parasimpatico vagale.
Le lesioni da mRNA COVID-19 e da vaccino adenovettoreDNA si sovrappongono alla malattia acuta grave COVID-19 e alla COVID lunga, ma sono più varie, data la più ampia biodistribuzione e la produzione prolungata della proteina spike. La miopericardite è riconosciuta, ma spesso è stata minimizzata come lieve e rara, tuttavia l’evidenza di una miopericardite subclinica relativamente comune legata al vaccino COVID-19 [113,115] e le prove autoptiche [246,247,248] suggeriscono un ruolo nelle morti improvvise in persone relativamente giovani e in forma [116,117]. Le proteine Spike hanno anche meccanismi che aumentano la trombosi attraverso l’infiammazione legata all’ACE-2, l’alterazione del sistema angiotensinico [119], il legame diretto con i recettori dell’ACE-2 sulle piastrine [1], l’alterazione dell’antitrombina [122], il ritardo della fibrinolisi [123] (preprint) e la riduzione della repulsione elettrostatica degli eritrociti che porta all’emoagglutinazione [124].
L’insorgenza di nuove malattie autoimmuni dopo la vaccinazione COVID-19 potrebbe essere correlata all’omologia della proteina spike, e nella malattia virale anche di altre proteine del SARS-CoV-2, con le proteine umane [5,138].
Il complesso mRNA-LNP attraversa la BBB e i disturbi neurologici sono altamente segnalati nei database di farmacovigilanza in seguito ai vaccini COVID-19. Sono in corso di elucidazione diversi meccanismi di spikeopatia come disturbi sottostanti che coinvolgono: permeabilità della BBB [128]; compromissione mitocondriale [168]; disregolazione dei periciti vascolari cerebrali [169]; neuroinfiammazione mediata da TLR4 [170]; morte cellulare dell’ippocampo [171]; disregolazione delle cascate del complemento e della coagulazione e dei neutrofili che causano coagulopatie [173] (preprint); neuroinfiammazione e demielinizzazione attraverso la disregolazione microgliale [174,177,180]; aumento dell’espressione di α-Syn coinvolta nelle malattie neurodegenerative [175]; livelli elevati di chemochina 11 con motivo C-C associati all’invecchiamento e alla conseguente perdita di cellule neurali e di mielina; legame con il recettore nicotinico α7 dell’acetilcolina (nAChR), aumento dei livelli di IL-1b e TNFα nel cervello che provoca alti livelli di infiammazione [172,177]; la subunità S1 è amiloidogenica [185]; disautonomia [96], sia per lesione diretta dei neuroni sia per meccanismi indiretti immuno-mediati, ad es. g., inibizione del nAChR α7; anosmia causata sia da vaccino che da malattia [44], anch’essa prodromica alla malattia di Parkinson.
Inoltre, autoanticorpi nel dominio globulare C-terminale possono causare la malattia di Creutzfeldt Jakob (CJD) [218], il miR-146a è alterato in associazione con il COVID-19 [222] e associato sia a infezioni virali che a malattie da prioni nel cervello, e S1 ha dimostrato di indurre la senescenza in cellule trasfettate.
La quantità di possibili meccanismi di danno mediato dagli spike nel cervello è pari, nella vita reale, alla prevalenza di effetti avversi neurologici e neurodegenerativi e richiede urgentemente ulteriori ricerche.
Il cancro, anche se non è stato dimostrato che sia causato dai vaccini, sembra seguire da vicino la vaccinazione e abbiamo esaminato le possibili cause sotto forma di interazioni delle proteine spike con fattori di trascrizione e geni soppressori del cancro.
Il vaccino è stato concepito per proteggere gli ultrasessantenni con il maggior rischio di mortalità da COVID-19 [10], ma un’analisi del rischio condotta da Dopp e Seneff (2022) [250] ha dimostrato che la probabilità di morire a causa dell’iniezione è inferiore solo dello 0,13% rispetto al rischio di morire a causa dell’infezione negli ultraottantenni.
Inoltre, l’invecchiamento naturale è accompagnato da cambiamenti nel sistema immunitario che compromettono la capacità di rispondere efficacemente a nuovi antigeni. Analogamente alle risposte ai virus stratificate per età, ciò significa che i vaccini diventano meno efficaci nell’indurre l’immunità negli anziani, con conseguente riduzione della capacità di combattere le nuove infezioni [251]. La vaccinazione con mRNA COVID-19 a due dosi ha conferito una risposta immunitaria adattativa limitata nei topi anziani, rendendoli suscettibili all’infezione da SARS-CoV-2 [252]. Il rischio di malattia grave tra i veterani statunitensi dopo la vaccinazione è rimasto associato all’età, secondo uno studio di Vo et al. Il rischio di infezioni gravi era inoltre più elevato in presenza di condizioni di immunocompromissione.
Infine, abbiamo esaminato le migliori serie di casi autoptici attualmente disponibili, eseguiti in Germania, che stabiliscono le connessioni tra la spikeopatia e le insufficienze d’organo multiple, le neuropatie e la morte.
9. Conclusioni
In questa revisione narrativa, abbiamo stabilito il ruolo della proteina spike della SARS-CoV-2, in particolare della subunità S1, come patogeno. È inoltre ormai evidente che le proteine spike ampiamente biodistribuite, prodotte da codici genici mRNA e adenovectorDNA, inducono un’ampia varietà di malattie. I meccanismi fisiopatologici e biochimici sottostanti sono in via di chiarimento. Anche i vettori lipidici-nanoparticelle per i vaccini mRNA e Novavax hanno proprietà pro-infiammatorie patologiche. L’intera premessa dei vaccini basati sui geni che producono antigeni estranei nei tessuti umani è gravida di rischi per i disturbi autoimmuni e infiammatori, soprattutto quando la distribuzione non è altamente localizzata.
Le implicazioni cliniche che ne derivano sono che i medici in tutti i campi della medicina devono essere consapevoli delle varie possibili presentazioni di malattie legate al vaccino COVID-19, sia acute che croniche, e del peggioramento di condizioni preesistenti.
Chiediamo inoltre di sospendere i vaccini COVID-19 basati sui geni e le matrici portanti lipido-nanoparticelle, nonché altri vaccini basati sulla tecnologia dell’mRNA o del vettore virale-DNA. Una strada più sicura è quella di utilizzare vaccini con proteine ricombinanti ben collaudate, tecnologie virali attenuate o inattivate, di cui esistono oggi molte per la vaccinazione contro la SARS-CoV-2.
Riferimenti bibliografici
- Zhang, S.; Liu, Y.; Wang, X.; Yang, L.; Li, H.; Wang, Y.; Liu, M.; Zhao, X.; Xie, Y.; Yang, Y.; et al. SARS-CoV-2 binds platelet ACE2 to enhance thrombosis in COVID-19. J. Hematol. Oncol. 2020, 13, 120. [Google Scholar] [CrossRef] [PubMed]
- Solis, O.; Beccari, A.R.; Iaconis, D.; Talarico, C.; Ruiz-Bedoya, C.A.; Nwachukwu, J.C.; Cimini, A.; Castelli, V.; Bertini, R.; Montopoli, M.; et al. The SARS-CoV-2 spike protein binds and modulates estrogen receptors. Sci. Adv. 2022, 8, eadd4150. [Google Scholar] [CrossRef] [PubMed]
- Kiaie, S.H.; Majidi Zolbanin, N.; Ahmadi, A.; Bagherifar, R.; Valizadeh, H.; Kashanchi, F.; Jafari, R. Recent advances in mRNA-LNP therapeutics: Immunological and pharmacological aspects. J. Nanobiotechnol. 2022, 20, 276. [Google Scholar] [CrossRef]
- Kariko, K.; Muramatsu, H.; Welsh, F.A.; Ludwig, J.; Kato, H.; Akira, S.; Weissman, D. Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Mol. Ther. 2008, 16, 1833–1840. [Google Scholar] [CrossRef]
- Therapeutic Goods Administration (TGA) FOI Reply 2389-6, p.45. Nonclinical Evaluation Report: BNT162b2 [mRNA] COVID-19 Vaccine (COMIRNATYTM). Submission No: PM-2020-05461-1-2. Sponsor: Pfizer Australia Pty Ltd. Australian Government Department of Health and Aged Care: 2021; FOI reply 2389-6. Available online: https://www.tga.gov.au/sites/default/files/foi-2389-06.pdf (accessed on 7 April 2023).
- AstraZeneca. 2.4 Nonclinical Overview AZD1222: Doc ID-004493554; MHRA: 2022-10-24-IR0751D 2021. Available online: https://icandecide.org/wp-content/uploads/2022/11/2022-10-24-IR0751D_Production_MHRA_000001-000166-166-pages.pdf (accessed on 12 July 2023).
- Geeraerts, T.; Guilbeau-Frugier, C.; Garcia, C.; Memier, V.; Raposo, N.; Bonneville, F.; Gales, C.; Darcourt, J.; Voisin, S.; Ribes, A.; et al. Immunohistologic features of cerebral venous thrombosis due to vaccine-induced immune thrombotic thrombocytopenia. Neurol. Neuroimmunol. Neuroinflamm. 2023, 10, e200127. [Google Scholar] [CrossRef] [PubMed]
- Lyons-Weiler, J. Pathogenic priming likely contributes to serious and critical illness and mortality in COVID-19 via autoimmunity. J. Transl. Autoimmun. 2020, 3, 100051. [Google Scholar] [CrossRef] [PubMed]
- Vojdani, A.; Vojdani, E.; Kharrazian, D. Reaction of Human Monoclonal Antibodies to SARS-CoV-2 Proteins With Tissue Antigens: Implications for Autoimmune Diseases. Front. Immunol. 2021, 11, 617089. [Google Scholar] [CrossRef]
- Reyna-Villasmil, E.; Caponcello, M.G.; Maldonado, N.; Olivares, P.; Caroccia, N.; Bonazzetti, C.; Tazza, B.; Carrara, E.; Giannella, M.; Tacconelli, E.; et al. Association of Patients’ Epidemiological Characteristics and Comorbidities with Severity and Related Mortality Risk of SARS-CoV-2 Infection: Results of an Umbrella Systematic Review and Meta-Analysis. Biomedicines 2022, 10, 2437. [Google Scholar] [CrossRef]
- Verity, R.; Okell, L.C.; Dorigatti, I.; Winskill, P.; Whittaker, C.; Imai, N.; Cuomo-Dannenburg, G.; Thompson, H.; Walker, P.G.T.; Fu, H.; et al. Estimates of the severity of coronavirus disease 2019: A model-based analysis. Lancet Infect. Dis. 2020, 20, 669–677. [Google Scholar] [CrossRef]
- Polack, F.P.; Thomas, S.J.; Kitchin, N.; Absalon, J.; Gurtman, A.; Lockhart, S.; Perez, J.L.; Pérez Marc, G.; Moreira, E.D.; Zerbini, C.; et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N. Engl. J. Med. 2020, 383, 2603–2615. [Google Scholar] [CrossRef]
- RMIT Fact Check. Did Pfizer Make a ‘Scandalous’ Admission to the European Parliament about Its COVID-19 Vaccine? ABC News. 2022. Available online: https://abc.net.au/news/2022-10-21/fact-check-pfizer-admission-transmission-european-parliament/101556606 (accessed on 6 July 2023).
- Watson, O.J.; Barnsley, G.; Toor, J.; Hogan, A.B.; Winskill, P.; Ghani, A.C. Global impact of the first year of COVID-19 vaccination: A mathematical modelling study. Lancet Infect. Dis. 2022, 22, 1293–1302. [Google Scholar] [CrossRef] [PubMed]
- Roussel, Y.; Giraud-Gatineau, A.; Jimeno, M.T.; Rolain, J.M.; Zandotti, C.; Colson, P.; Raoult, D. SARS-CoV-2: Fear versus data. Int. J. Antimicrob. Agents 2020, 55, 105947. [Google Scholar] [CrossRef] [PubMed]
- Ioannidis, J.P.A.; Cripps, S.; Tanner, M.A. Forecasting for COVID-19 has failed. Int. J. Forecast. 2022, 38, 423–438. [Google Scholar] [CrossRef]
- Rid, A.; Lipsitch, M.; Miller, F.G. The Ethics of Continuing Placebo in SARS-CoV-2 Vaccine Trials. JAMA 2021, 325, 219–220. [Google Scholar] [CrossRef]
- WHO Ad Hoc Expert Group on the Next Steps for Covid-19 Evaluation; Krause, P.R.; Fleming, T.R.; Longini, I.M.; Peto, R.; Beral, V.; Bhargava, B.; Cravioto, A.; Cramer, J.P.; Ellenberg, S.S.; et al. Placebo-Controlled Trials of Covid-19 Vaccines—Why We Still Need Them. N. Engl. J. Med. 2021, 384, e2. [Google Scholar] [CrossRef] [PubMed]
- Control Group Cooperative. The Covid Vaccine Study. 2021. Available online: https://www.vcgwiki.com/the-covid-vaccine-study (accessed on 3 July 2023).
- Verkerk, R.; Kathrada, N.; Plothe, C.; Lindley, K. Self-selected COVID-19 “unvaccinated” cohort reports favorable health outcomes and unjustified discrimination in global survey. Int. J. Vaccine Theory Pract. Res. 2022, 2, 321–354. [Google Scholar] [CrossRef]
- NSW Health. NSW Respiratory Surveillance Report—Week Ending 31 December 2022. 2022. Available online: https://www.health.nsw.gov.au/Infectious/covid-19/Documents/weekly-covid-overview-20221231.pdf (accessed on 10 July 2023).
- Therapeutic Goods Administration (TGA). COVID-19 vaccines regulatory status. Australian Government Department of Health and Aged Care: Tga.gov.au. 2023. Available online: https://www.tga.gov.au/products/covid-19/covid-19-vaccines/covid-19-vaccine-provisional-registrations (accessed on 7 April 2023).
- Therapeutic Goods Administration (TGA). TGA provisionally approves Novavax (Biocelect Pty Ltd’s COVID-19 vaccine NUVAXOVID. Australian Government Department of Health and Aged Care: Tga.gov.au. 2023. Available online: https://www.tga.gov.au/news/media-releases/tga-provisionally-approves-novavax-biocelect-pty-ltds-covid-19-vaccine-nuvaxovid (accessed on 7 April 2023).
- Senate Committee: Community Affairs Committee. Answers to Questions on Notice, Outcome: 1—Health Policy, Access and Support, 2022–2023 Budget Estimates October and November; Australian Federal Parliament: Canberra, Australia, 2022. [Google Scholar]
- Kuba, K.; Imai, Y.; Rao, S.; Gao, H.; Guo, F.; Guan, B.; Huan, Y.; Yang, P.; Zhang, Y.; Deng, W.; et al. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus-induced lung injury. Nat. Med. 2005, 11, 875–879. [Google Scholar] [CrossRef]
- Wrapp, D.; Wang, N.; Corbett, K.S.; Goldsmith, J.A.; Hsieh, C.L.; Abiona, O.; Graham, B.S.; McLellan, J.S. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science 2020, 367, 1260–1263. [Google Scholar] [CrossRef] [PubMed]
- Cuffari, B. What are Spike Proteins? News-Medical.Net. 2021. Available online: https://www.news-medical.net/health/What-are-Spike-Proteins.aspx (accessed on 26 April 2023).
- Carnell, G.W.; Ciazynska, K.A.; Wells, D.A.; Xiong, X.; Aguinam, E.T.; McLaughlin, S.H.; Mallery, D.; Ebrahimi, S.; Ceron-Gutierrez, L.; Asbach, B.; et al. SARS-CoV-2 Spike Protein Stabilized in the Closed State Induces Potent Neutralizing Responses. J. Virol. 2021, 95, e0020321. [Google Scholar] [CrossRef]
- Seneff, S.; Kyriakopoulos, A.M.; Nigh, G.; McCullough, P.A. A Potential Role of the Spike Protein in Neurodegenerative Diseases: A Narrative Review. Cureus 2023, 15, e34872. [Google Scholar] [CrossRef]
- Changeux, J.P.; Amoura, Z.; Rey, F.A.; Miyara, M. A nicotinic hypothesis for Covid-19 with preventive and therapeutic implications. Comptes Rendus Biol. 2020, 343, 33–39. [Google Scholar] [CrossRef] [PubMed]
- Nirthanan, S. Snake three-finger α-neurotoxins and nicotinic acetylcholine receptors: Molecules, mechanisms and medicine. Biochem. Pharmacol. 2020, 181, 114168. [Google Scholar] [CrossRef] [PubMed]
- Farsalinos, K.; Niaura, R.; Le Houezec, J.; Barbouni, A.; Tsatsakis, A.; Kouretas, D.; Vantarakis, A.; Poulas, K. Editorial: Nicotine and SARS-CoV-2: COVID-19 may be a disease of the nicotinic cholinergic system. Toxicol. Rep. 2020, 7, 658–663. [Google Scholar] [CrossRef] [PubMed]
- O’Brien, B.C.V.; Weber, L.; Hueffer, K.; Weltzin, M.M. SARS-CoV-2 spike ectodomain targets α7 nicotinic acetylcholine receptors. J. Biol. Chem. 2023, 299, 104707. [Google Scholar] [CrossRef]
- ACROBiosystems. An Overview of Different COVID-19 Vaccines. ACROBiosystems Insights, 2021. An Overview of Different COVID-19 Vaccines—ACROBiosystems. Available online: https://www.acrobiosystems.com/A1374-An-Overview-of-Different-COVID-19-Vaccines.html (accessed on 7 April 2023).
- Wikipedia. List of COVID-19 vaccine authorizations. 2023. Available online: https://en.wikipedia.org/wiki/List_of_COVID-19_vaccine_authorizations (accessed on 7 April 2023).
- U.S. Food and Drug Administration (FDA). FDA News Release: FDA Approves First-of-Its Kind Targeted RNA-Based Therapy to Treat a Rare Disease. FDA Newsroom FDA.gov.au. 2018. Available online: https://www.fda.gov/news-events/press-announcements/fda-approves-first-its-kind-targeted-rna-based-therapy-treat-rare-disease (accessed on 7 April 2023).
- Dolgin, E. The tangled history of mRNA vaccines. Nature 2021, 597, 318–324. [Google Scholar] [CrossRef]
- McCann, N.; O’Connor, D.; Lambe, T.; Pollard, A.J. Viral vector vaccines. Curr. Opin. Immunol. 2022, 77, 102210. [Google Scholar] [CrossRef]
- Altman, P.M.; Rowe, J.; Hoy, W.; Brady, G.; Lefringhausen, A.; Cosford, R.; Wauchope, B. Did National Security Imperatives Compromise COVID-19 Vaccine Safety? Trial Site News. 2022. Available online: https://www.trialsitenews.com/a/did-national-security-imperatives-compromise-covid-19-vaccine-safety-adfea242 (accessed on 9 June 2023).
- Lalani, H.S.; Nagar, S.; Sarpatwari, A.; Barenie, R.E.; Avorn, J.; Rome, B.N.; Kesselheim, A.S. US public investment in development of mRNA covid-19 vaccines: Retrospective cohort study. BMJ 2023, 380, e073747. [Google Scholar] [CrossRef] [PubMed]
- McCullough, P. America’s long, expensive, and deadly love affair with mRNA. In Courageous Discourse, Substack.com: 2023. Available online: https://petermcculloughmd.substack.com/p/americas-long-expensive-and-deadly (accessed on 15 March 2023).
- Turni, C.; Lefringhausen, A. Covid-19 vaccines—An Australian Review. J. Clin. Exp. Immunol. 2022, 7, 491–508. [Google Scholar]
- Ndeupen, S.; Qin, Z.; Jacobsen, S.; Bouteau, A.; Estanbouli, H.; Igyártó, B.Z. The mRNA-LNP platform’s lipid nanoparticle component used in preclinical vaccine studies is highly inflammatory. iScience 2021, 24, 103479. [Google Scholar] [CrossRef]
- Wick, P.; Malek, A.; Manser, P.; Meili, D.; Maeder-Althaus, X.; Diener, L.; Diener, P.A.; Zisch, A.; Krug, H.F.; von Mandach, U. Barrier capacity of human placenta for nanosized materials. Environ. Health Perspect. 2010, 118, 432–436. [Google Scholar] [CrossRef]
- Zhou, Y.; Peng, Z.; Seven, E.S.; Leblanc, R.M. Crossing the blood-brain barrier with nanoparticles. J. Control Release 2018, 270, 290–303. [Google Scholar] [CrossRef]
- Japanese Pharmaceuticals and Medical Devices Agency (PMDA). SARS-CoV-2 mRNA Vaccine (BNT162, PF-07302048). 2021. Available online: https://www.pmda.go.jp/drugs/2021/P20210212001/672212000_30300AMX00231_I100_1.pdf (accessed on 7 April 2023).
- Judicial Watch. Pfizer/BioNTech Study Found Lipid Nanoparticles Materials Outside Injection Site in Test Animals. judicialwatch.org. 2022. Available online: https://www.judicialwatch.org/nanoparticles-materials-outside-injection-site/ (accessed on 12 July 2023).
- Di, J.; Du, Z.; Wu, K.; Jin, S.; Wang, X.; Li, T.; Xu, Y. Biodistribution and Non-linear Gene Expression of mRNA LNPs Affected by Delivery Route and Particle Size. Pharm. Res. 2022, 39, 105–114. [Google Scholar] [CrossRef] [PubMed]
- Morais, P.; Adachi, H.; Yu, Y.T. The Critical Contribution of Pseudouridine to mRNA COVID-19 Vaccines. Front. Cell. Dev. Biol. 2021, 9, 789427. [Google Scholar] [CrossRef] [PubMed]
- Fertig, T.E.; Chitoiu, L.; Marta, D.S.; Ionescu, V.S.; Cismasiu, V.B.; Radu, E.; Angheluta, G.; Dobre, M.; Serbanescu, A.; Hinescu, M.E.; et al. Vaccine mRNA can be detected in blood at 15 days post-vaccination. Biomedicines 2022, 10, 1538. [Google Scholar] [CrossRef] [PubMed]
- Castruita, J.A.S.; Schneider, U.V.; Mollerup, S.; Leineweber, T.D.; Weis, N.; Bukh, J.; Pedersen, M.S.; Westh, H. SARS-CoV-2 spike mRNA vaccine sequences circulate in blood up to 28 days after COVID-19 vaccination. APMIS 2023, 131, 128–132. [Google Scholar] [CrossRef]
- Ogata, A.F.; Cheng, C.-A.; Desjardins, M.; Senussi, Y.; Sherman, A.C.; Powell, M.; Novack, L.; Von, S.; Li, X.; Baden, L.R.; et al. Circulating severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) vaccine antigen detected in the plasma of mRNA-1273 vaccine recipients. Clin. Infect. Dis. 2021, 74, 715–718. [Google Scholar] [CrossRef]
- Röltgen, K.; Nielsen, S.C.A.; Silva, O.; Younes, S.F.; Zaslavsky, M.; Costales, C.; Yang, F.; Wirz, O.F.; Solis, D.; Hoh, R.A.; et al. Immune imprinting, breadth of variant recognition, and germinal center response in human SARS-CoV-2 infection and vaccination. Cell 2022, 185, 1025–1040.e14. [Google Scholar] [CrossRef]
- Yonker, L.M.; Swank, Z.; Bartsch, Y.C.; Burns, M.D.; Kane, A.; Boribong, B.P.; Davis, J.P.; Loiselle, M.; Novak, T.; Senussi, Y.; et al. Circulating Spike Protein Detected in Post-COVID-19 mRNA Vaccine Myocarditis. Circulation 2023, 147, 867–876. [Google Scholar] [CrossRef]
- Jikomes, N. Pseudouridine, mRNA Vaccines & Spike Protein Persistence. In Mind & Matter with Nick Jikomes, mindandmatter.substack.com. 2022. Available online: https://mindandmatter.substack.com/p/pseudouridine-mrna-vaccines-and-spike (accessed on 7 April 2023).
- Yong, S.J. mRNA Vaccine Stays Active in the Body Longer than Expected, New Data Shows. But it isn’t Dangerous. In Microbial Instincts, Medium.com. 2022. Available online: https://medium.com/microbial-instincts/mrna-vaccine-stays-active-in-the-body-longer-than-expected-new-data-shows-but-it-isnt-harmful-aaa40544bc06 (accessed on 7 April 2023).
- Bansal, S.; Perincheri, S.; Fleming, T.; Poulson, C.; Brian, T.; Bremner, M.R.; Mohanakumar, T. Cutting Edge: Circulating Exosomes with COVID Spike Protein Are Induced by BNT162b2 (Pfizer–BioNTech) Vaccination prior to Development of Antibodies: A Novel Mechanism for Immune Activation by mRNA Vaccines. J. Immunol. 2021, 207, 2405–2410. [Google Scholar] [CrossRef]
- Yamamoto, M.; Kase, M.; Sano, H.; Kamijima, R.; Sano, S. Persistent varicella zoster virus infection following mRNA COVID-19 vaccination was associated with the presence of encoded spike protein in the lesion. J. Cutan. Immunol. Allergy 2023, 6, 18–23. [Google Scholar] [CrossRef]
- Maugeri, M.; Nawaz, M.; Papadimitriou, A. Linkage between endosomal escape of LNP-mRNA and loading into EVs for transport to other cells. Nat. Commun. 2019, 10, 4333. [Google Scholar] [CrossRef]
- Wang, R.; Huang, K. CCL11 increases the proportion of CD4+CD25+Foxp3+ Treg cells and the production of IL 2 and TGF β by CD4+ T cells via the STAT5 signaling pathway. Mol. Med. Rep. 2020, 21, 2522–2532. [Google Scholar] [CrossRef] [PubMed]
- Segalla, G. Chemical-physical criticality and toxicological potential of lipid nanomaterials contained in a COVID-19 mRNA vaccine. Int. J. Vaccine Theory Pract. Res. Inj. Causes Treat. 2023, 3, 787–817. [Google Scholar] [CrossRef]
- European Parliament. Parliamentary question P-005690/2021: Excipients ALC-0315 and ALC-0159. Priority Question for Written Answer to the Commission, Rule 138, Guido Reil (ID); European Parliament Europarl.europa.eu 2021. Available online: https://www.europarl.europa.eu/doceo/document/P-9-2021-005690_EN.html (accessed on 4 June 2023).
- Bushmanova, S.V.; Ivanov, A.O.; Buyevich, Y.U. The effect of an electrolyte on phase separation in colloids. In Physica A: Statistical Mechanics and Its Applications; Elsevier: Amsterdam, The Netherlands, 1994; Volume 202, pp. 175–195. [Google Scholar]
- Poon, W.; Zhang, Y.N.; Ouyang, B.; Kingston, B.R.; Wu, J.L.Y.; Wilhelm, S.; Chan, W.C.W. Elimination Pathways of Nanoparticles. ACS Nano 2019, 13, 5785–5798. [Google Scholar] [CrossRef] [PubMed]
- Trougakos, I.P.; Terpos, E.; Alexopoulos, H.; Politou, M.; Paraskevis, D.; Scorilas, A.; Kastritis, E.; Andreakos, E.; Dimopoulos, M.A. COVID-19 mRNA vaccine-induced adverse effects: Unwinding the unknowns. Trends Mol. Med. 2022, 28, 800–802. [Google Scholar] [CrossRef]
- Halma, M.T.; Rose, J.; Lawrie, T. The novelty of mRNA viral vaccines and potential harms: A scoping review. J 2023, 6, 220–235. [Google Scholar] [CrossRef]
- Yamamoto, K. Adverse effects of Covid-19 vaccines and measures to prevent them. Virol. J. 2022, 19, 100. [Google Scholar] [CrossRef]
- Sahin, U.; Oehm, P.; Derhovanessian, E.; Jabulowsky, R.A.; Vormehr, M.; Gold, M.; Maurus, D.; Schwarck-Kokarakis, D.; Kuhn, A.N.; Omokoko, T.; et al. An RNA vaccine drives immunity in checkpoint-inhibitor-treated melanoma. Nature 2020, 585, 107–112. [Google Scholar] [CrossRef]
- Doener, F.; Hong, H.S.; Meyer, I.; Tadjalli-Mehr, K.; Daehling, A.; Heidenreich, R.; Koch, S.D.; Fotin-Mleczek, M.; Gnad-Vogt, U. RNA-based adjuvant CV8102 enhances the immunogenicity of a licensed rabies vaccine in a first-in-human trial. Vaccine 2019, 37, 1819–1826. [Google Scholar] [CrossRef]
- Anttila, V.; Saraste, A.; Knuuti, J.; Jaakkola, P.; Hedman, M.; Svedlund, S.; Lagerström-Fermér, M.; Kjaer, M.; Jeppsson, A.; Gan, L.M. Synthetic mRNA Encoding VEGF-A in Patients Undergoing Coronary Artery Bypass Grafting: Design of a Phase 2a Clinical Trial. Mol. Ther. Methods Clin. Dev. 2020, 18, 464–472. [Google Scholar] [CrossRef]
- Crescioli, S.; Correa, I.; Karagiannis, P.; Davies, A.M.; Sutton, B.J.; Nestle, F.O.; Karagiannis, S.N. IgG4 Characteristics and Functions in Cancer Immunity. Curr. Allergy Asthma Rep. 2016, 16, 7. [Google Scholar] [CrossRef] [PubMed]
- Schlaudecker, E.P.; McNeal, M.M.; Dodd, C.N.; Ranz, J.B.; Steinhoff, M.C. Pregnancy modifies the antibody response to trivalent influenza immunization. J. Infect. Dis. 2012, 206, 1670–1673. [Google Scholar] [CrossRef] [PubMed]
- Zhang, X.; Lu, H.; Peng, L.; Zhou, J.; Wang, M.; Li, J.; Liu, Z.; Zhang, W.; Zhao, Y.; Zeng, X.; et al. The role of PD-1/PD-Ls in the pathogenesis of IgG4-related disease. Rheumatology 2022, 61, 815–825. [Google Scholar] [CrossRef] [PubMed]
- Medsafe. Alert Communication: Myocarditis and Pericarditis have been Reported with Nuvaxovid (Novavax COVID-19 vaccine). New Zealand Medicines and Medical Devices Safety Authority: Medsafe.govt.nz. 2022. Available online: https://www.medsafe.govt.nz/safety/Alerts/nuvaxovid-myocarditis.asp (accessed on 7 April 2023).
- AstraZeneca. 2.4 Nonclinical Overview AZD1222: Doc ID-004365565; MHRA: 2022-10-24-IR0751D 2020. Available online: https://icandecide.org/wp-content/uploads/2022/11/2022-10-24-IR0751D_Production_MHRA_000001-000166-166-pages.pdf (accessed on 12 July 2023).
- Biotech, B. Covaxin—India’s First Indigenous COVID-19 Vaccine. 2022. Available online: https://www.bharatbiotech.com/covaxin.html (accessed on 8 April 2023).
- Sinovac. Overview of CoronaVac. 2021. Available online: http://www.coronavac.cn/ (accessed on 8 April 2023).
- Vaxine. COVID-19 Project. 2022. Available online: https://vaxine.net/projects/ (accessed on 11 June 2023).
- CinnaGen. SpikoGen: Recombinant COVID-19 Vaccine. 2022. Available online: https://www.cinnagen.com/Product.aspx?t=2&l=1&Id=607 (accessed on 11 June 2023).
- Tabarsi, P.; Anjidani, N.; Shahpari, R.; Mardani, M.; Sabzvari, A.; Yazdani, B.; Roshanzamir, K.; Bayatani, B.; Taheri, A.; Petrovsky, N.; et al. Safety and immunogenicity of SpikoGen®, an Advax-CpG55.2-adjuvanted SARS-CoV-2 spike protein vaccine: A phase 2 randomized placebo-controlled trial in both seropositive and seronegative populations. Clin. Microbiol. Infect. 2022, 28, 1263–1271. [Google Scholar] [CrossRef]
- Tabarsi, P.; Anjidani, N.; Shahpari, R.; Roshanzamir, K.; Fallah, N.; Andre, G.; Petrovsky, N.; Barati, S. Immunogenicity and safety of SpikoGen®, an adjuvanted recombinant SARS-CoV-2 spike protein vaccine as a homologous and heterologous booster vaccination: A randomized placebo-controlled trial. Immunology 2022, 167, 340–353. [Google Scholar] [CrossRef]
- Tabarsi, P.; Anjidani, N.; Shahpari, R.; Mardani, M.; Sabzvari, A.; Yazdani, B.; Kafi, H.; Fallah, N.; Ebrahimi, A.; Taheri, A.; et al. Evaluating the efficacy and safety of SpikoGen®, an Advax-CpG55.2-adjuvanted severe acute respiratory syndrome coronavirus 2 spike protein vaccine: A phase 3 randomized placebo-controlled trial. Clin. Microbiol. Infect. 2023, 29, 215–220. [Google Scholar] [CrossRef]
- Scendoni, R.; Cingolani, M. What do we know about pathological mechanism and pattern of lung injury related to SARS-CoV-2 Omicron variant? Diagn. Pathol. 2023, 18, 18. [Google Scholar] [CrossRef]
- Department of Health and Aged Care. Comirnaty (Pfizer). Australian Government. 2022. Available online: https://www.health.gov.au/our-work/covid-19-vaccines/our-vaccines/pfizer (accessed on 11 June 2023).
- Therapeutic Goods Administration (TGA). Moderna COVID-19 Bivalent (SPIKEVAX Bivalent Original/Omicron BA.4-5) Booster Dose Vaccine. Australian Government Department of Health and Aged Care. 2023. Available online: https://www.tga.gov.au/products/covid-19/covid-19-vaccines/covid-19-vaccine-provisional-registrations/moderna-covid-19-bivalent-spikevax-bivalent-originalomicron-ba4-5-booster-dose-vaccine (accessed on 11 June 2023).
- Cosentino, M.; Marino, F. Understanding the pharmacology of COVID-19 mRNA vaccines: Playing dice with the spike? Int. J. Mol. Sci. 2022, 23, 10881. [Google Scholar] [CrossRef]
- Singh, H.N.; Singh, A.B. S2 Subunit of SARS-nCoV-2 Interacts with Tumor Suppressor Protein p53 and BRCA: An In Silico Study. Transl. Oncol. 2020, 13, 100814. [Google Scholar] [CrossRef]
- Barreda, D.; Santiago, C.; Rodríguez, J.R.; Rodríguez, J.F.; Casasnovas, J.M.; Mérida, I.; Ávila-Flores, A. SARS-CoV-2 Spike Protein and Its Receptor Binding Domain Promote a Proinflammatory Activation Profile on Human Dendritic Cells. Cells 2021, 10, 3279. [Google Scholar] [CrossRef]
- Suzuki, Y.J.; Nikolaienko, S.I.; Dibrova, V.A.; Dibrova, Y.V.; Vasylyk, V.M.; Novikov, M.Y.; Shults, N.V.; Gychka, S.G. SARS-CoV-2 spike protein-mediated cell signaling in lung vascular cells. Vascul. Pharmacol. 2021, 137, 106823. [Google Scholar] [CrossRef] [PubMed]
- Colunga Biancatelli, R.M.L.; Solopov, P.A.; Sharlow, E.R.; Lazo, J.S.; Marik, P.E.; Catravas, J.D. The SARS-CoV-2 spike protein subunit S1 induces COVID-19-like acute lung injury in Κ18-hACE2 transgenic mice and barrier dysfunction in human endothelial cells. Am. J. Physiol. Lung Cell. Mol. Physiol. 2021, 321, L477–L484. [Google Scholar] [CrossRef]
- McKernan, K.; Kyriakopoulos, A.M.; McCullough, P.A. Differences in vaccine and SARS-CoV-2 replication derived mRNA: Implications for cell biology and future disease. OSF Preprints 2021. [Google Scholar] [CrossRef]
- Lei, Y.; Zhang, J.; Schiavon, C.R.; He, M.; Chen, L.; Shen, H.; Zhang, Y.; Yin, Q.; Cho, Y.; Andrade, L.; et al. SARS-CoV-2 Spike Protein Impairs Endothelial Function via Downregulation of ACE 2. Circ. Res. 2021, 128, 1323–1326. [Google Scholar] [CrossRef] [PubMed]
- Nadwa, E.H.; Al-Kuraishy, H.M.; Al-Gareeb, A.I.; Elekhnawy, E.; Albogami, S.M.; Alorabi, M.; Batiha, G.E.; De Waard, M. Cholinergic dysfunction in COVID-19: Frantic search and hoping for the best. Naunyn Schmiedebergs Arch. Pharmacol. 2023, 396, 453–468. [Google Scholar] [CrossRef] [PubMed]
- Alexandris, N.; Lagoumintzis, G.; Chasapis, C.T.; Leonidas, D.D.; Papadopoulos, G.E.; Tzartos, S.J.; Tsatsakis, A.; Eliopoulos, E.; Poulas, K.; Farsalinos, K. Nicotinic cholinergic system and COVID-19: Toxicol. Rep. 2021, 8, 73–83. [Google Scholar] [CrossRef]
- Hollenhorst, M.I.; Krasteva-Christ, G. Nicotinic Acetylcholine Receptors in the Respiratory Tract. Molecules 2021, 26, 6097. [Google Scholar] [CrossRef]
- Al-Kuraishy, H.M.; Al-Gareeb, A.I.; Qusti, S.; Alshammari, E.M.; Gyebi, G.A.; Batiha, G.E. Covid-19-Induced Dysautonomia: A Menace of Sympathetic Storm. ASN Neuro 2021, 13, 17590914211057635. [Google Scholar] [CrossRef]
- Patterson, B.K.; Seethamraju, H.; Dhody, K.; Corley, M.J.; Kazempour, K.; Lalezari, J.; Pang, A.P.S.; Sugai, C.; Mahyari, E.; Francisco, E.B.; et al. CCR5 inhibition in critical COVID-19 patients decreases inflammatory cytokines, increases CD8 T-cells, and decreases SARS-CoV2 RNA in plasma by day 14. Int. J. Infect. Dis. 2021, 103, 25–32. [Google Scholar] [CrossRef]
- Henrion-Caude, A. Spikopathy: The Pathology of the Spike Protein. Conference Presentation, General Assembly Meeting, World Council for Health. worldcouncilforhealth.org. 2021. Available online: https://worldcouncilforhealth.org/multimedia/alexandra-henrion-caude-france-spikopathy/ (accessed on 7 April 2023).
- Anderson, S. CBER Plans for Monitoring COVID-19 Vaccine Safety and Effectiveness. U.S. Food & Drug Administration (FDA): Vaccines and Related Biological Products Advisory Committee meeting. 2020. Available online: https://www.fda.gov/media/143557/download (accessed on 7 April 2023).
- React19. 3400+ COVID Vaccine Publications and Case Reports. 2022. Available online: https://react19.org/1250-covid-vaccine-reports/ (accessed on 11 June 2023).
- Avolio, E.; Carrabba, M.; Milligan, R.; Kavanagh Williamson, M.; Beltrami, A.P.; Gupta, K.; Elvers, K.T.; Gamez, M.; Foster, R.R.; Gillespie, K.; et al. The SARS-CoV-2 Spike protein disrupts human cardiac pericytes function through CD147 receptor-mediated signalling: A potential non-infective mechanism of COVID-19 microvascular disease. Clin. Sci. 2021, 135, 2667–2689. [Google Scholar] [CrossRef]
- Cao, X.; Nguyen, V.; Tsai, J.; Gao, C.; Tian, Y.; Zhang, Y.; Carver, W.; Kiaris, H.; Cui, T.; Tan, W. The SARS-CoV-2 Spike protein induces long-term transcriptional perturbations of mitochondrial metabolic genes, causes cardiac fibrosis, and reduces myocardial contractile in obese mice. Mol. Metab. 2023, 74, 101756. [Google Scholar] [CrossRef] [PubMed]
- Baumeier, C.; Aleshcheva, G.; Harms, D.; Gross, U.; Hamm, C.; Assmus, B.; Westenfeld, R.; Kelm, M.; Rammos, S.; Wenzel, P.; et al. Intramyocardial Inflammation after COVID-19 Vaccination: An Endomyocardial Biopsy-Proven Case Series. Int. J. Mol. Sci. 2022, 23, 6940. [Google Scholar] [CrossRef] [PubMed]
- Barmada, A.; Klein, J.; Ramaswamy, A.; Brodsky, N.N.; Jaycox, J.R.; Sheikha, H.; Jones, K.M.; Habet, V.; Campbell, M.; Sumida, T.S.; et al. Cytokinopathy with aberrant cytotoxic lymphocytes and profibrotic myeloid response in SARS-CoV-2 mRNA vaccine-associated myocarditis. Sci. Immunol. 2023, 8, eadh3455. [Google Scholar] [CrossRef]
- Wu, C.T.; Chin, S.C.; Chu, P.H. Acute Fulminant Myocarditis After ChAdOx1 nCoV-19 Vaccine: A Case Report and Literature Review. Front. Cardiovasc. Med. 2022, 9, 856991. [Google Scholar] [CrossRef] [PubMed]
- Sulemankhil, I.; Abdelrahman, M.; Negi, S.I. Temporal Association Between the COVID-19 Ad26.COV2.S Vaccine and Acute Myocarditis: A Case Report and Literature Review. Cardiovasc. Revasc. Med. 2022, 38, 117–123. [Google Scholar] [CrossRef]
- Olejniczak, M.; Schwartz, M.; Webber, E.; Shaffer, A.; Perry, T.E. Viral Myocarditis-Incidence, Diagnosis and Management. J. Cardiothorac. Vasc. Anesth. 2020, 34, 1591–1601. [Google Scholar] [CrossRef]
- Basso, C. Myocarditis. N. Engl. J. Med. 2022, 387, 1488–1500. [Google Scholar] [CrossRef]
- Simone, A.; Herald, J.; Chen, A.; Gulati, N.; Shen, A.Y.; Lewin, B.; Lee, M.S. Acute Myocarditis Following COVID-19 mRNA Vaccination in Adults Aged 18 Years or Older. JAMA Intern. Med. 2021, 181, 1668–1670. [Google Scholar] [CrossRef]
- Lane, S.; Yeomans, A.; Shakir, S. Systematic review of spontaneous reports of myocarditis and pericarditis in transplant recipients and immunocompromised patients following COVID-19 mRNA vaccination. BMJ Open 2022, 12, e060425. [Google Scholar] [CrossRef]
- Naik, R. FDA: Summary Basis for Regulatory Action. fda.gov. 2021. Available online: https://www.fda.gov/media/151733/download (accessed on 8 November 2022).
- Tschöpe, C.; Ammirati, E.; Bozkurt, B.; Caforio, A.L.P.; Cooper, L.T.; Felix, S.B.; Hare, J.M.; Heidecker, B.; Heymans, S.; Hübner, N.; et al. Myocarditis and inflammatory cardiomyopathy: Current evidence and future directions. Nat. Rev. Cardiol. 2021, 18, 169–193. [Google Scholar] [CrossRef]
- Mansanguan, S.; Charunwatthana, P.; Piyaphanee, W.; Dechkhajorn, W.; Poolcharoen, A.; Mansanguan, C. Cardiovascular Manifestation of the BNT162b2 mRNA COVID-19 Vaccine in Adolescents. Trop. Med. Infect. Dis. 2022, 7, 196. [Google Scholar] [CrossRef] [PubMed]
- Müller, C.; Buergin, N.; Lopez-Ayala, P.; Hirsiger, J.R.; Mueller, P.; Median, D.; Glarner, N.; Rumora, K.; Herrmann, T.; Koechlin, L.; et al. Sex-specific differences in myocardial injury incidence after COVID-19 mRNA-1273 Booster Vaccination. Eur. J. Heart Fail, 2023; accepted author manuscript. [Google Scholar] [CrossRef]
- Manno, E.C.; Amodio, D.; Cotugno, N.; Rossetti, C.; Giancotta, C.; Santilli, V.; Zangari, P.; Rotulo, G.A.; Villani, A.; Giglioni, E.; et al. Higher Troponin Levels on Admission are associated With Persistent Cardiac Magnetic Resonance Lesions in Children Developing Myocarditis After mRNA-Based COVID-19 Vaccination. Pediatr. Infect. Dis. J. 2023, 42, 166–171. [Google Scholar] [CrossRef] [PubMed]
- Dowd, E. Cause Unknown: The Epidemic of Sudden Deaths in 2021 and 2022; Children’s Health Defence: Washington, DC, USA, 2022. [Google Scholar]
- Dowd, E.; Nunes, Y.; Alegria, C. US Disability Data: Part 4—Relation with Excess Deaths. Bureau of Labor Statistics (BLS). Phinancetechnologies.com. 2022. Available online: https://phinancetechnologies.com/HumanityProjects/US%20Disabilities%20-%20Part4.htm (accessed on 8 November 2022).
- Therapeutic Goods Administration (TGA), FOI Reply 4093-02. Advisory Committee on Vaccines (ACV) Meeting 22, Minutes on item 2.1, BNT162b2 [mRNA] vaccine. 2021. Available online: https://www.tga.gov.au/sites/default/files/2023-03/foi-4093-02.pdf (accessed on 7 April 2023).
- Angeli, F.; Spanevello, A.; Reboldi, G.; Visca, D.; Verdecchia, P. SARS-CoV-2 vaccines: Lights and shadows. Eur. J. Intern. Med. 2021, 88, 1–8. [Google Scholar] [CrossRef]
- Angeli, F.; Reboldi, G.; Trapasso, M.; Zappa, M.; Spanevello, A.; Verdecchia, P. COVID-19, vaccines and deficiency of ACE2 and other angiotensinases. Closing the loop on the “Spike effect”. Eur. J. Intern. Med. 2022, 103, 23–28. [Google Scholar] [CrossRef]
- Kuhn, C.C.; Basnet, N.; Bodakuntla, S.; Alvarez-Brecht, P.; Nichols, S.; Martinez-Sanchez, A.; Agostini, L.; Soh, Y.M.; Takagi, J.; Biertümpfel, C.; et al. Direct Cryo-ET observation of platelet deformation induced by SARS-CoV-2 spike protein. Nat. Commun. 2023, 14, 620. [Google Scholar] [CrossRef]
- Zheng, Y.; Zhao, J.; Li, J.; Guo, Z.; Sheng, J.; Ye, X.; Jin, G.; Wang, C.; Chai, W.; Yan, J.; et al. SARS-CoV-2 spike protein causes blood coagulation and thrombosis by competitive binding to heparan sulfate. Int. J. Biol. Macromol. 2021, 193, 1124–1129. [Google Scholar] [CrossRef] [PubMed]
- Ryu, J.K.; Sozmen, E.G.; Dixit, K.; Montano, M.; Matsui, Y.; Liu, Y.; Helmy, E.; Deerinck, T.J.; Yan, Z.; Schuck, R.; et al. SARS-CoV-2 spike protein induces abnormal inflammatory blood clots neutralized by fibrin immunotherapy. bioRxiv 2021. preprint. [Google Scholar] [CrossRef]
- Boschi, C.; Scheim, D.E.; Bancod, A.; Militello, M.; Bideau, M.L.; Colson, P.; Fantini, J.; Scola, B. SARS-CoV-2 Spike Protein Induces Hemagglutination: Implications for COVID-19 Morbidities and Therapeutics and for Vaccine Adverse Effects. Int. J. Mol. Sci. 2022, 23, 15480. [Google Scholar] [CrossRef]
- Purnell, M.C.; Skrinjar, T.J. Bioelectric Field Enhancement: The Influence on Membrane Potential and Cell Migration In Vitro. Adv. Wound Care 2016, 5, 539–545. [Google Scholar] [CrossRef]
- Purnell, M.C.; Skrinjar, T.J. The dielectrophoretic disassociation of chloride ions and the influence on diamagnetic anisotropy in cell membranes. Discov. Med. 2016, 22, 257–273. [Google Scholar]
- Papasimakis, N.; Fedotov, V.A.; Savinov, V.; Raybould, T.A.; Zheludev, N.I. Electromagnetic toroidal excitations in matter and free space. Nat. Mater. 2016, 15, 263–271. [Google Scholar] [CrossRef] [PubMed]
- Purnell, M.C.; Butawan, M.B.A.; Ramsey, R.D. Bio-field array: A dielectrophoretic electromagnetic toroidal excitation to restore and maintain the golden ratio in human erythrocytes. Physiol. Rep. 2018, 6, e13722. [Google Scholar] [CrossRef] [PubMed]
- Kooijman, S.; Meurs, I.; van der Stoep, M.; Habets, K.L.; Lammers, B.; Berbée, J.F.; Havekes, L.M.; van Eck, M.; Romijn, J.A.; Korporaal, S.J.; et al. Hematopoietic α7 nicotinic acetylcholine receptor deficiency increases inflammation and platelet activation status, but does not aggravate atherosclerosis. J. Thromb. Haemost. 2015, 13, 126–135. [Google Scholar] [CrossRef] [PubMed]
- Li, J.X.; Wang, Y.H.; Bair, H.; Hsu, S.B.; Chen, C.; Wei, J.C.; Lin, C.J. Risk assessment of retinal vascular occlusion after COVID-19 vaccination. NPJ Vaccines 2023, 8, 64. [Google Scholar] [CrossRef]
- Herrera-Comoglio, R.; Lane, S. Vaccine-Induced Immune Thrombocytopenia and Thrombosis after the Sputnik V Vaccine. N. Engl. J. Med. 2022, 387, 1431–1432. [Google Scholar] [CrossRef] [PubMed]
- Buoninfante, A.; Andeweg, A.; Baker, A.T.; Borad, M.; Crawford, N.; Dogné, J.M.; Garcia-Azorin, D.; Greinacher, A.; Helfand, R.; Hviid, A.; et al. Understanding thrombosis with thrombocytopenia syndrome after COVID-19 vaccination. NPJ Vaccines 2022, 7, 141. [Google Scholar] [CrossRef]
- Leung, H.H.L.; Perdomo, J.; Ahmadi, Z.; Zhen, S.S.; Rashi, F.N.; Enjeti, A.; Ting, S.B.; Chong, J.J.H.; Chong, B.H. NETosis and thrombosis in vaccine-induced immune thrombotic thrombocytopenia. Nat. Commun. 2022, 13, 5206. [Google Scholar] [CrossRef]
- Greinacher, A.; Schönborn, L.; Siegerist, F.; Steil, L.; Palankar, R.; Handtke, S.; Reder, A.; Thiele, T.; Aurich, K.; Methling, K.; et al. Pathogenesis of vaccine-induced immune thrombotic thrombocytopenia (VITT). Seminars Hematol. 2022, 59, 97–107. [Google Scholar] [CrossRef]
- Talotta, R.; Robertson, E.S. Antiphospholipid antibodies and risk of poast-COVID-19 vaccination thrombophilia: The straw that breaks the camels’s back? Cytokine Growth Factor Rev. 2021, 60, 52–60. [Google Scholar] [CrossRef]
- Khavinson, V.; Terekhov, A.; Kormilets, D.; Maryanovich, A. Homology between SARS CoV-2 and human proteins. Sci. Rep. 2021, 11, 17199. [Google Scholar] [CrossRef]
- Kelleni, M. SARS-CoV-2 vaccination, autoimmunity, antibody dependent Covid-19 enhancement and other potential risks: Beneath the tip of the iceberg. Int. J. Pulm. Respir. Sci. 2021, 5, 555658. [Google Scholar] [CrossRef]
- Alqatari, S.; Ismail, M.; Hasan, M.; Bukhara, R.; Al Argan, R.; Alwaheed, A.; Alkhafaji, D.; Ahmed, S.; Hadhiah, K.; Alamri, T.; et al. Emergence of post COVID-19 vaccine autoimmune diseases: A single centre study. Infect. Drug Resist. 2023, 16, 1263–1278. [Google Scholar] [CrossRef] [PubMed]
- Rodriguez, Y.; Rojas, M.; Beltran, S.; Polo, F.; Camacho-Dominguez, L.; Morales, S.D.; Gershwin, M.E.; Anaya, J.M. Autoimmune and autoinflammatory conditions after COVID-19 vaccination. New case reports and updated literature review. J. Autoimmun. 2022, 132, 102898. [Google Scholar] [CrossRef]
- Lansang, R.P.; Amdemichael, E.; Sajic, D. IgA pemphigus following COVID-19 vaccination: A case report. SAGE Open Med. Case Rep. 2023, 11, 2050313X231181022. [Google Scholar] [CrossRef]
- Minakawa, S.; Matsuzaki, Y.; Yao, S.; Sagara, C.; Akasaka, E.; Koga, H.; Ishii, N.; Hashimoto, T.; Sawamura, D. Case report: A case of epidermolysis bullosa acquisita with IgG and IgM anti-basement membrane zone antibodies relapsed after COVID-19 mRNA vaccination. Front. Med. 2023, 10, 1093827. [Google Scholar] [CrossRef]
- Makiyama, A.; Abe, Y.; Furusawa, H.; Kogami, M.; Ando, T.; Tada, K.; Onimaru, M.; Ishizu, A.; Yamaji, K.; Tamura, N. Polyarteritis nodosa diagnosed in a young male after COVID-19 vaccine: A case report. Mod. Rheumatol. Case Rep. 2023. [Google Scholar] [CrossRef] [PubMed]
- Takedani, K.; Notsu, M.; Ishiai, N.; Asami, Y.; Uchida, K.; Kanasaki, K. Graves’ disease after exposure to the SARS-CoV-2 vaccine: A case report and review of the literature. BMC Endocr. Disord. 2023, 23, 132. [Google Scholar] [CrossRef]
- Morimoto, N.; Mori, T.; Shioji, S.; Taguchi, T.; Watanabe, H.; Sakai, K.; Mori, K.; Yamamura, A.; Hanioka, A.; Akagi, Y.; et al. Rapidly progressive IgA nephropathy with membranoproliferative glomerulonephritis-like lesions in an elderly man following the third dose of an mRNA COVID-19 vaccine: A case report. BMC Nephrol. 2023, 24, 108. [Google Scholar] [CrossRef]
- Aochi, S.; Uehara, M.; Yamamoto, M. IgG4-related Disease Emerging after COVID-19 mRNA Vaccination. Intern. Med. 2023, 62, 1547–1551. [Google Scholar] [CrossRef]
- Cam, F.; Gok, G.; Celiker, H. Granulomatous anterior uveitis following mRNA-based COVID-19 vaccination: A case report. Indian J. Ophthalmol. 2023, 71, 1033–1035. [Google Scholar] [CrossRef]
- Yamamoto, M.; Keino, D.; Sumii, S.; Yokosuka, T.; Goto, H.; Inui, A.; Sogo, T.; Kawakami, M.; Tanaka, M.; Yanagimachi, M. Severe Hepatitis-associated Aplastic Anemia Following COVID-19 mRNA Vaccination. Intern. Med. 2023, 62, 1813–1816. [Google Scholar] [CrossRef] [PubMed]
- Talotta, R. Do COVID-19 RNA-based vaccines put at risk of immune-mediated diseases? In reply to “potential antigenic cross-reactivity between SARS-CoV-2 and human tissue with a possible link to an increase in autoimmune diseases”. Clin. Immunol. 2021, 224, 108665. [Google Scholar] [CrossRef]
- Irrgang, P.; Gerling, J.; Kocher, K.; Lapuente, D.; Steininger, P.; Habenicht, K.; Wytopil, M.; Beileke, S.; Schäfer, S.; Zhong, J.; et al. Class switch toward noninflammatory, spike-specific IgG4 antibodies after repeated SARS-CoV-2 mRNA vaccination. Sci. Immunol. 2023, 8, eade2798. [Google Scholar] [CrossRef] [PubMed]
- Uversky, V.N.; Redwan, E.M.; Makis, W.; Rubio-Casillas, A. IgG4 Antibodies Induced by Repeated Vaccination May Generate Immune Tolerance to the SARS-CoV-2 Spike Protein. Vaccines 2023, 11, 991. [Google Scholar] [CrossRef]
- Patel, N.R.; Anzalone, M.L.; Buja, L.M.; Elghetany, M.T. Sudden cardiac death due to coronary artery involvement by IgG4-related disease: A rare, serious complication of a rare disease. Arch. Pathol. Lab. Med. 2014, 138, 833–836. [Google Scholar] [CrossRef]
- Gutierrez, P.S.; Schultz, T.; Siqueira, S.A.; de Figueiredo Borges, L. Sudden coronary death due to IgG4-related disease. Cardiovasc. Pathol. 2013, 22, 505–507. [Google Scholar] [CrossRef]
- Martín-Nares, E.; Saavedra-González, V.; Fagundo-Sierra, R.; Santinelli-Núñez, B.E.; Romero-Maceda, T.; Calderón-Vasquez, K.; Hernandez-Molina, G. Serum immunoglobulin free light chains and their association with clinical phenotypes, serology and activity in patients with IgG4-related disease. Sci. Rep. 2021, 11, 1832. [Google Scholar] [CrossRef]
- Tsai, H.C.; Tung, H.Y.; Liu, C.W.; Su, C.F.; Sun, Y.S.; Chen, W.S.; Chen, M.H.; Lai, C.C.; Liao, H.T.; Yang, Y.Y.; et al. Significance of high serum IgG4 in complete or non-full-fledged IgG4-related disease-a retrospective investigation of 845 patients and its clinical relevance. Clin. Rheumatol. 2022, 41, 115–122. [Google Scholar] [CrossRef] [PubMed]
- Campochiaro, C.; Ramirez, G.A.; Bozzolo, E.P.; Lanzillotta, M.; Berti, A.; Baldissera, E.; Dagna, L.; Praderio, L.; Scotti, R.; Tresoldi, M.; et al. IgG4-related disease in Italy: Clinical features and outcomes of a large cohort of patients. Scand. J. Rheumatol. 2016, 45, 135–145. [Google Scholar] [CrossRef]
- Wallace, Z.S.; Zhang, Y.; Perugino, C.A.; Naden, R.; Choi, H.K.; Stone, J.H.; ACR/EULAR IgG4-RD Classification Criteria Committee. Clinical phenotypes of IgG4-related disease: An analysis of two international cross-sectional cohorts. Ann. Rheum. Dis. 2019, 78, 406–412. [Google Scholar] [CrossRef] [PubMed]
- Chen, L.Y.C.; Mattman, A.; Seidman, M.A.; Carruthers, M.N. IgG4-related disease: What a hematologist needs to know. Haematologica 2019, 104, 444–455. [Google Scholar] [CrossRef]
- Lin, W.; Lu, S.; Chen, H.; Wu, Q.; Fei, Y.; Li, M.; Zhang, X.; Tian, X.; Zheng, W.; Leng, X.; et al. Clinical characteristics of immunoglobulin G4-related disease: A prospective study of 118 Chinese patients. Rheumatology 2015, 54, 1982–1990. [Google Scholar] [CrossRef]
- Della-Torre, E.; Lanzillotta, M.; Doglioni, C. Immunology of IgG4-related disease. Clin. Exp. Immunol. 2015, 181, 191–206. [Google Scholar] [CrossRef] [PubMed]
- Stone, J.R. Aortitis, periaortitis, and retroperitoneal fibrosis, as manifestations of IgG4-related systemic disease. Curr. Opin. Rheumatol. 2011, 23, 88–94. [Google Scholar] [CrossRef] [PubMed]
- Prapruttam, D.; Hedgire, S.S.; Mani, S.E.; Chandramohan, A.; Shyamkumar, N.K.; Harisinghani, M. Tuberculosis–the great mimicker. Semin. Ultrasound CT MR 2014, 35, 195–214. [Google Scholar] [CrossRef]
- (PHMPT) Public Health & Medical Professionals for Transparency, Pfizer’s Documents. 2022. Available online: https://phmpt.org/ (accessed on 10 July 2023).
- Pfizer. 5.3.6 Cumulative Analysis of Post-Authorization of Adverse Event Reports of PF-07302048 (BNT162B2) Received through 28-Feb-2021. FDA-CBER-2021-5683-0000054. Public Health and Medical Professionals for Transparency (PHMPT). Available online: https://phmpt.org/pfizer-16-plus-documents/ (accessed on 14 July 2023).
- Nuovo, G.J.; Suster, D.; Sawant, D.; Mishra, A.; Michaille, J.J.; Tili, E. The amplification of CNS damage in Alzheimer’s disease due to SARS-CoV2 infection. Ann. Diagn. Pathol. 2022, 61, 152057. [Google Scholar] [CrossRef]
- Rastogi, A.; Bingeliene, A.; Strafella, A.P.; Tang-Wai, D.F.; Wu, P.E.; Mandell, D.M. Reversible neurological and brain MRI changes following COVID-19 vaccination: A case report. J. Neuroradiol. 2022, 49, 428–430. [Google Scholar] [CrossRef]
- Rhea, E.M.; Logsdon, A.F.; Hansen, K.M.; Williams, L.M.; Reed, M.J.; Baumann, K.K.; Holden, S.J.; Raber, J.; Banks, W.A.; Erickson, M.A. The S1 protein of SARS-CoV-2 crosses the blood-brain barrier in mice. Nat. Neurosci. 2021, 24, 368–378. [Google Scholar] [CrossRef]
- Mörz, M. A Case Report: Multifocal Necrotizing Encephalitis and Myocarditis after BNT162b2 mRNA Vaccination against COVID-19. Vaccines 2022, 10, 1651. [Google Scholar] [CrossRef]
- Kim, E.S.; Jeon, M.T.; Kim, K.S.; Lee, S.; Kim, S.; Kim, D.G. Spike Proteins of SARS-CoV-2 Induce Pathological Changes in Molecular Delivery and Metabolic Function in the Brain Endothelial Cells. Viruses 2021, 13, 2021. [Google Scholar] [CrossRef] [PubMed]
- Khaddaj-Mallat, R.; Aldib, N.; Bernard, M.; Paquette, A.S.; Ferreira, A.; Lecordier, S.; Saghatelyan, A.; Flamand, L.; ElAli, A. SARS-CoV-2 deregulates the vascular and immune functions of brain pericytes via Spike protein. Neurobiol. Dis. 2021, 161, 105561. [Google Scholar] [CrossRef] [PubMed]
- Fontes-Dantas, F.L.; Fernandes, G.G.; Gutman, E.G.; De Lima, E.V.; Antonio, L.S.; Hammerle, M.B.; Mota-Araujo, H.P.; Colodeti, L.C.; Araújo, S.M.B.; Froz, G.M.; et al. SARS-CoV-2 Spike protein induces TLR4-mediated long-term cognitive dysfunction recapitulating post-COVID-19 syndrome in mice. Cell Rep. 2023, 42, 112189. [Google Scholar] [CrossRef] [PubMed]
- Oh, J.; Cho, W.H.; Barcelon, E.; Kim, K.H.; Hong, J.; Lee, S.J. SARS-CoV-2 spike protein induces cognitive deficit and anxiety-like behavior in mouse via non-cell autonomous hippocampal neuronal death. Sci. Rep. 2022, 12, 5496. [Google Scholar] [CrossRef] [PubMed]
- Tillman, T.S.; Chen, Q.; Bondarenko, V.; Coleman, J.A.; Xu, Y.; Tang, P. SARS-CoV-2 Spike Protein Downregulates Cell Surface alpha7nAChR through a Helical Motif in the Spike Neck. ACS Chem. Neurosci. 2023, 14, 689–698. [Google Scholar] [CrossRef]
- Rong, Z.; Mai, H.; Kapoor, S.; Puelles, V.G.; Czogalla, J.; Schädler, J.; Vering, J.; Delbridge, C.; Steinke, H.; Frenzel, H.; et al. SARS-CoV-2 Spike Protein Accumulation in the Skull-Meninges-Brain Axis: Potential Implications for Long-Term Neurological Complications in post-COVID-19. bioRxiv 2023, preprint. [Google Scholar] [CrossRef]
- Olajide, O.A.; Iwuanyanwu, V.U.; Adegbola, O.D.; Al-Hindawi, A.A. SARS-CoV-2 Spike Glycoprotein S1 Induces Neuroinflammation in BV-2 Microglia. Mol. Neurobiol. 2022, 59, 445–458. [Google Scholar] [CrossRef]
- Wu, Z.; Zhang, X.; Huang, Z.; Ma, K. SARS-CoV-2 Proteins Interact with Alpha Synuclein and Induce Lewy Body-like Pathology In Vitro. Int. J. Mol. Sci. 2022, 23, 3394. [Google Scholar] [CrossRef]
- Winkler, E.S.; Bailey, A.L.; Kafai, N.M.; Sharmila, N.; McCune, B.T.; Jinsheng, Y.; Fox, J.M.; Chen, R.E.; Earnest, J.J.; Keeler, S.P.; et al. SARS-CoV-2 infection of human ACE2-transgenic mice causes severe lung inflammation and impaired function. Nat. Immunol. 2020, 21, 1327–1335. [Google Scholar] [CrossRef]
- Lykhmus, O.; Kalashnyk, O.; Skok, M. Positive Allosteric Modulation of Alpha7 Nicotinic Acetylcholine Receptors Transiently Improves Memory but Aggravates Inflammation in LPS-Treated Mice. Front. Aging Neurosci. 2020, 11, 359. [Google Scholar] [CrossRef]
- Lykhmus, O.; Kalashnyk, O.; Koval, L.; Krynina, O.; Komisarenko, S.; Skok, M. Immunization with 674–685 fragment of SARS-Cov-2 spike protein induces neuroinflammation and impairs episodic memory of mice. Biochem. Biophys. Res. Commun. 2022, 622, 57–63. [Google Scholar] [CrossRef]
- Villeda, S.A.; Luo, J.; Mosher, K.I.; Zou, B.; Britschgi, M.; Bieri, G.; Stan, T.M.; Fainberg, N.; Ding, Z.; Eggel, A.; et al. The ageing systemic milieu negatively regulates neurogenesis and cognitive function. Nature 2011, 477, 90–94. [Google Scholar] [CrossRef] [PubMed]
- Fernández-Castañeda, A.; Lu, P.; Geraghty, A.C.; Song, E.; Lee, M.H.; Wood, J.; O’Dea, M.R.; Dutton, S.; Shamardani, K.; Nwangwu, K.; et al. Mild respiratory COVID can cause multi-lineage neural cell and myelin dysregulation. Cell 2022, 185, 2452–2468.e16. [Google Scholar] [CrossRef] [PubMed]
- Shrestha, N.K.; Burke, P.C.; Nowacki, A.S.; Simon, J.F.; Hagen, A.; Gordon, S.M. Effectiveness of the Coronavirus Disease 2019 Bivalent Vaccine. Open Forum Infect. Dis. 2023, 10, ofad209. [Google Scholar] [CrossRef] [PubMed]
- Coleman, J.M.; Naik, C.; Holguin, F.; Ray, A.; Ray, P.; Trudeau, J.B.; Wenzel, S.E. Epithelial eotaxin-2 and eotaxin-3 expression: Relation to asthma severity, luminal eosinophilia and age at onset. Thorax 2012, 67, 1061–1066. [Google Scholar] [CrossRef]
- Rojas-Ramos, E.; Avalos, A.F.; Perez-Fernandez, L.; Cuevas-Schacht, F.; Valencia-Maqueda, E.; Teran, L.M. Role of the chemokines RANTES, monocyte chemotactic proteins-3 and −4, and eotaxins-1 and −2 in childhood asthma. Eur. Respir. J. 2003, 22, 310–316. [Google Scholar] [CrossRef]
- Holgate, S.T. Mucosal Immunology; Academic Press: Cambridge, MA, USA, 2015. [Google Scholar] [CrossRef]
- Nyström, S.; Hammarström, P. Amyloidogenesis of SARS-CoV-2 Spike Protein. J. Am. Chem. Soc. 2022, 144, 8945–8950. [Google Scholar] [CrossRef]
- Maatuk, N.; Samson, A.O. Modeling the binding mechanism of Alzheimer’s Aβ1-42 to nicotinic acetylcholine receptors based on similarity with snake α-neurotoxins. Neurotoxicology 2013, 34, 236–242. [Google Scholar] [CrossRef]
- Lasala, M.; Fabiani, C.; Corradi, J.; Antollini, S.; Bouzat, C. Molecular Modulation of Human α7 Nicotinic Receptor by Amyloid-β Peptides. Front. Cell. Neurosci. 2019, 13, 37. [Google Scholar] [CrossRef]
- Dhakal, S.; Wyant, C.E.; George, H.E.; Morgan, S.E.; Rangachari, V. Prion-like C-Terminal Domain of TDP-43 and α-Synuclein Interact Synergistically to Generate Neurotoxic Hybrid Fibrils. J. Mol. Biol. 2021, 433, 166953. [Google Scholar] [CrossRef]
- Tetz, G.; Tetz, V. Prion-like Domains in Spike Protein of SARS-CoV-2 Differ across Its Variants and Enable Changes in Affinity to ACE2. Microorganisms 2022, 10, 280. [Google Scholar] [CrossRef]
- Nonaka, T.; Hasegawa, M. TDP-43 Prions. Cold Spring Harb. Perspect. Med. 2018, 8, a024463. [Google Scholar] [CrossRef]
- Classen, J. COVID-19 RNA based vaccines and the risk of prion disease. Microbiol. Infect. Dis. 2021, 5, 1–3. [Google Scholar] [CrossRef]
- Idrees, D.; Kumar, V. SARS-CoV-2 spike protein interactions with amyloidogenic proteins: Potential clues to neurodegeneration. Biochem. Biophys. Res. Commun. 2021, 554, 94–98. [Google Scholar] [CrossRef] [PubMed]
- Kuvandik, A.; Özcan, E.; Serin, S.; Sungurtekin, H. Creutzfeldt-Jakob Disease After the COVID-19 Vaccination. Turk. J. Intensive Care 2021, 20, 61–64. [Google Scholar] [CrossRef]
- Wang, F.; Wang, X.; Yuan, C.G.; Ma, J. Generating a prion with bacterially expressed recombinant prion protein. Science 2010, 327, 1132–1135. [Google Scholar] [CrossRef]
- Young, M.J.; O’Hare, M.; Matiello, M.; Schmahmann, J.D. Creutzfeldt-Jakob disease in a man with COVID-19: SARS-CoV-2-accelerated neurodegeneration? Brain Behav. Immun. 2020, 89, 601–603. [Google Scholar] [CrossRef]
- d’Errico, P.; Meyer-Luehmann, M. Mechanisms of Pathogenic Tau and Abeta Protein Spreading in Alzheimer’s Disease. Front. Aging Neurosci. 2020, 12, 265. [Google Scholar] [CrossRef]
- Duda, J.E.; Lee, V.M.; Trojanowski, J.Q. Neuropathology of synuclein aggregates. J. Neurosci. Res. 2000, 61, 121–127. [Google Scholar] [Google Scholar] [CrossRef]
- MedAlerts.org. This is VAERS ID 1754471. National Vaccine Information Center: 2021. Available online: https://medalerts.org/vaersdb/findfield.php (accessed on 4 July 2023).
- MedAlerts.org. This is VAERS ID 1777781. National Vaccine Information Center: 2021. Available online: https://medalerts.org/vaersdb/findfield.php (accessed on 4 July 2023).
- Australian Bureau of Statistics (ABS). Provisional Mortality Statistics: Reference Period: Jan—Dec 2022; abs.gov.au, 2023. Available online: https://www.abs.gov.au/statistics/health/causes-death/provisional-mortality-statistics/jan-dec-2022 (accessed on 7 July 2023).
- Australian Bureau of Statistics (ABS). Provisional Mortality Statistics; Australian Bureau of Statistics (ABS): Canberra, Australia, 2023.
- Kuo, P.H.; Chiang, C.H.; Wang, Y.T.; Doudeva, L.G.; Yuan, H.S. The crystal structure of TDP-43 RRM1-DNA complex reveals the specific recognition for UG- and TG-rich nucleic acids. Nucleic Acids Res. 2014, 42, 4712–4722. [Google Scholar] [CrossRef]
- King, O.D.; Gitler, A.D.; Shorter, J. The tip of the iceberg: RNA-binding proteins with prion-like domains in neurodegenerative disease. Brain Res. 2012, 1462, 61–80. [Google Scholar] [CrossRef] [PubMed]
- Tavassoly, O.; Safavi, F.; Tavassoly, I. Seeding Brain Protein Aggregation by SARS-CoV-2 as a Possible Long-Term Complication of COVID-19 Infection. ACS Chem. Neurosci. 2020, 11, 3704–3706. [Google Scholar] [CrossRef] [PubMed]
- Mueller, B.K.; Subramaniam, S.; Senes, A. A frequent, GxxxG-mediated, transmembrane association motif is optimized for the formation of interhelical Calpha-H hydrogen bonds. Proc. Natl. Acad. Sci. USA 2014, 111, E888–E895. [Google Scholar] [CrossRef] [PubMed]
- Prusiner, S.B. Novel proteinaceous infectious particles cause scrapie. Science 1982, 216, 136–144. [Google Scholar] [CrossRef]
- Decock, M.; Stanga, S.; Octave, J.N.; Dewachter, I.; Smith, S.O.; Constantinescu, S.N.; Kienlen-Campard, P. Glycines from the APP GXXXG/GXXXA Transmembrane Motifs Promote Formation of Pathogenic Abeta Oligomers in Cells. Front. Aging Neurosci. 2016, 8, 107. [Google Scholar] [CrossRef] [PubMed]
- Seneff, S.; Nigh, G. Worse Than the Disease? Reviewing Some Possible Unintended Consequences of the mRNA Vaccines Against COVID-19. Int. J. Vaccine Theory Pract. Res. 2021, 2, 38–79. [Google Scholar] [CrossRef]
- Liu-Yesucevitz, L.; Bilgutay, A.; Zhang, Y.J.; Vanderweyde, T.; Citro, A.; Mehta, T.; Zaarur, N.; McKee, A.; Bowser, R.; Sherman, M.; et al. Tar DNA binding protein-43 (TDP-43) associates with stress granules: Analysis of cultured cells and pathological brain tissue. PLoS ONE 2010, 5, e13250. [Google Scholar] [CrossRef]
- Bosco, D.A.; Lemay, N.; Ko, H.K.; Zhou, H.; Burke, C.; Kwiatkowski, T.J., Jr.; Sapp, P.; McKenna-Yasek, D.; Brown, R.H., Jr.; Hayward, L.J. Mutant FUS proteins that cause amyotrophic lateral sclerosis incorporate into stress granules. Hum. Mol. Genet. 2010, 19, 4160–4175. [Google Scholar] [CrossRef]
- Cox, P.A.; Richer, R.; Metcalf, J.S.; Banack, S.A.; Codd, G.A.; Bradley, W.G. Cyanobacteria and BMAA exposure from desert dust: A possible link to sporadic ALS among Gulf War veterans. Amyotroph. Lateral Scler. 2009, 10 (Suppl S2), 109–117. [Google Scholar] [CrossRef]
- Stefano, G.B.; Buttiker, P.; Weissenberger, S.; Anders, M.; Raboch, J.; Ptacek, R.; Kream, R.M. Potential Prion Involvement in Long COVID-19 Neuropathology, Including Behavior. Cell. Mol. Neurobiol. 2023, 43, 2621–2626. [Google Scholar] [CrossRef]
- Donaldson, D.S.; Bradford, B.M.; Else, K.J.; Mabbott, N.A. Accelerated onset of CNS prion disease in mice co-infected with a gastrointestinal helminth pathogen during the preclinical phase. Sci. Rep. 2020, 10, 4554. [Google Scholar] [CrossRef] [PubMed]
- Liddelow, S.A.; Guttenplan, K.A.; Clarke, L.E.; Bennett, F.C.; Bohlen, C.J.; Schirmer, L.; Bennett, M.L.; Munch, A.E.; Chung, W.S.; Peterson, T.C.; et al. Neurotoxic reactive astrocytes are induced by activated microglia. Nature 2017, 541, 481–487. [Google Scholar] [CrossRef] [PubMed]
- Makarava, N.; Chang, J.C.; Molesworth, K.; Baskakov, I.V. Region-specific glial homeostatic signature in prion diseases is replaced by a uniform neuroinflammation signature, common for brain regions and prion strains with different cell tropism. Neurobiol. Dis. 2020, 137, 104783. [Google Scholar] [CrossRef]
- Xu, J.; Wei, H.; You, P.; Sui, J.; Xiu, J.; Zhu, W.; Xu, Q. Non-neutralizing antibodies to SARS-Cov-2-related linear epitopes induce psychotic-like behavior in mice. Front. Mol. Neurosci. 2023, 16, 1177961. [Google Scholar] [CrossRef]
- Kyriakopoulos, A.M.; Nigh, G.; McCullough, P.A.; Seneff, S. Mitogen Activated Protein Kinase (MAPK) Activation, p53, and Autophagy Inhibition Characterize the Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Spike Protein Induced Neurotoxicity. Cureus 2022, 14, e32361. [Google Scholar] [CrossRef]
- Thomas, C.A.; Paquola, A.C.M.; Muotri, A.R. LINE-1 retrotransposition in the nervous system. Annu. Rev. Cell Dev. Biol. 2012, 28, 555–573. [Google Scholar] [CrossRef]
- Terry, D.M.; Devine, S.E. Aberrantly High Levels of Somatic LINE-1 Expression and Retrotransposition in Human Neurological Disorders. Front. Genet. 2020, 10, 1244. [Google Scholar] [CrossRef]
- Shamila, D.; Alipoor, S.D.; Moratz, E.; Garssen, J.; Movassaghi, M.; Mirsaeidi, M.; Adcock, I.M. Exosomes and Exosomal miRNA in Respiratory Diseases. Mediat. Inflamm. 2016, 2016, 5628404. [Google Scholar] [CrossRef]
- Visacri, M.B.; Nicoletti, A.S.; Pincinato, E.C.; Loren, P.; Saavedra, N.; Saavedra, K.; Salazar, L.A.; Moriel, P. Role of miRNAs as biomarkers of COVID-19: A scoping review of the status and future directions for research in this field. Biomark. Med. 2021, 15, 1785–1795. [Google Scholar] [CrossRef] [PubMed]
- Pogue, A.I.; Lukiw, W.J. microRNA-146a-5p, Neurotropic Viral Infection and Prion Disease (PrD). Int. J. Mol. Sci. 2021, 22, 9198. [Google Scholar] [CrossRef]
- Lukiw, W.J.; Dua, P.; Pogue, A.I.; Eicken, C.; Hill, J.M. Upregulation of micro RNA-146a (miRNA-146a), a marker for inflammatory neurodegeneration, in sporadic Creutzfeldt-Jakob disease (sCJD) and Gerstmann-Straussler-Scheinker (GSS) syndrome. J. Toxicol. Environ. Health A 2011, 74, 1460–1468. [Google Scholar] [CrossRef] [PubMed]
- Norrby, E. Prions and protein-folding diseases. J. Intern. Med. 2011, 270, 1–14. [Google Scholar] [CrossRef] [PubMed]
- Horwich, A.L.; Weissman, J.S. Deadly conformations—Protein misfolding in prion disease. Cell 1997, 89, 499–510. [Google Scholar] [CrossRef] [PubMed]
- Tripathi, U.; Nchioua, R.; Prata, L.G.P.L.; Zhu, Y.; Gerdes, E.O.W.; Giorgadze, N.; Pirtskhalava, T.; Parker, E.; Xue, A.; Espindola-Netto, J.M.; et al. SARS-CoV-2 causes senescence in human cells and exacerbates the senescence-associated secretory phenotype through TLR-3. Aging 2021, 13, 21838–21854. [Google Scholar] [CrossRef]
- Sfera, A.; Thomas, K.; Sfera, D.; Anton, J.; Andronescu, C.; Jafri, N.; Susanna, S.; Kozlakidis, Z. Do messenger RNA vaccines induce pathological syncytial? Int. J. Pathol. Clin. Res. 2022, 8, 137. [Google Scholar]
- Huang, L.; Jin, R.; Li, J.; Luo, K.; Huang, T.; Wu, D.; Wang, W.; Chen, R.; Xiao, G. Macromolecular crowding converts the human recombinant PrPC to the soluble neurotoxic beta-oligomers. FASEB J. 2010, 24, 3536–3543. [Google Scholar] [CrossRef]
- Dalgleish, A. Interview with Professor Angus Dalgleish. Immunotherapy 2016, 8, 1271–1276. [Google Scholar] [CrossRef]
- Dalgleish, A. As an Oncologist I am Seeing People with Stable Cancer Rapidly Progress after Being Forced to Have a Booster. Letter to Dr Abbassi, Editor-in-Chief BMJ. dailysceptic.org. 2022. Available online: https://dailysceptic.org/2022/11/26/as-an-oncologist-i-am-seeing-people-with-stable-cancer-rapidly-progress-after-being-forced-to-have-a-booster/ (accessed on 11 June 2023).
- Pio, R.; Ajona, D.; Ortiz-Espinosa, S.; Mantovani, A.; Lambris, J.D. Complementing the cancer-immunity cycle. Front. Immunol. 2019, 10, 774. [Google Scholar] [CrossRef]
- Alsaab, H.O.; Sau, S.; Alzhrani, R.; Tatiparti, K.; Bhise, K.; Kashaw, S.K.; Lyer, A.K. PD-1 and PD-L1 checkpoint signaling inhibition for cancer immunotherapy: Mechanism, combinations, and clinical outcome. Front. Pharmacol. 2017, 8, 561. [Google Scholar] [CrossRef]
- Bishawi, M.; Bowles, D.; Pla, M.M.; Oakes, F.; Chiang, Y.S.; Schroder, J.; Milano, C.; Glass, C. PD-1 and PD-L1 expression in cardiac transplantation. Cardiovasc. Pathol. 2021, 54, 107331. [Google Scholar] [CrossRef]
- Loacker, L.; Kimpel, J.; Bánki, Z.; Schmidt, C.Q.; Griesmacher, A.; Anliker, M. Increased PD-L1 surface expression on peripheral blood granulocytes and monocytes after vaccination with SARS-CoV2 mRNA or vector vaccine. Clin. Chem. Lab. Med. 2022, 61, e17–e19. [Google Scholar] [CrossRef] [PubMed]
- Diskin, C.; Ryan, T.A.J.; O’Neill, L.J. Modification of Proteins by Metabolites in Immunity. Immunity 2021, 54, 19–31. [Google Scholar] [CrossRef]
- Mishra, R.; Banerjea, A.C. SARS-CoV-2 Spike targets USP33-IRF9 axis via exosomal miR-148a to activate human microglia. Front. Immunol. 2021, 12, 656700. [Google Scholar] [CrossRef] [PubMed]
- Seneff, S.; Nigh, G.; Kyriakopoulos, A.M.; McCoulough, P.A. Innate immune suppression by SARS-CoV-2 mRNA vaccinations: The role of G-quadruplexes, exosomes, and MicroRNAs. Food Chem. Toxicol. 2022, 164, 113008. [Google Scholar] [CrossRef]
- Hofer, M.J.; Li, W.; Lim, S.L.; Campbell, I.L. The type I interferon-alpha mediates a more severe neurological disease in the absence of the canonical signaling molecule interferon regulatory factor 9. J. Neurosci. 2010, 30, 1149–1157. [Google Scholar] [CrossRef] [PubMed]
- Rasmussen, S.A.; Abul-Husn, N.S.; Casanova, J.L.; Daly, M.J.; Rehm, H.L.; Murray, M.F. The intersection of genetics and COVID-19 in 2021: Preview of the 2021 Rodney Howell Symposium. Genet. Med. 2021, 23, 1001–1003. [Google Scholar] [CrossRef]
- Liu, J.; Wang, J.; Xu, J.; Xia, H.; Wang, Y.; Zhang, C.; Chen, W.; Zhang, H.; Liu, Q.; Zhu, R.; et al. Comprehensive investigations revealed consistent pathophysiological alterations after vaccination with COVID-19 vaccines. Cell Discov. 2021, 7, 99. [Google Scholar] [CrossRef]
- Li, S.; Silvestri, V.; Leslie, G.; Rebbeck, T.R.; Neuhausen, S.L.; Hopper, J.L.; Nielsen, H.R.; Lee, A.; Yang, X.; McGuffog, L.; et al. Cancer Risks Associated With BRCA1 and BRCA2 Pathogenic Variants. J. Clin. Oncol. 2022, 40, 1529–1541. [Google Scholar] [CrossRef]
- Nuovo, G.J.; Magro, C.; Shaffer, T.; Awad, H.; Suster, D.; Mikhail, S.; He, B.; Michaille, J.J.; Liechty, B.; Tili, E. Endothelial cell damage is the central part of COVID-19 and a mouse model induced by injection of the S1 subunit of the spike protein. Ann. Diagn. Pathol. 2021, 51, 151682. [Google Scholar] [CrossRef]
- Mezache, L.; Nuovo, G.J.; Suster, D.; Tili, E.; Awad, H.; Radwański, P.B.; Veeraraghavan, R. Histologic, viral, and molecular correlates of heart disease in fatal COVID-19. Ann. Diagn. Pathol. 2022, 60, 151983. [Google Scholar] [CrossRef]
- Choi, J. Fauci: Amount of Virus in ‘Breakthrough Delta Cases Almost Identical’ to Unvaccinated. The Hill: Thehill.com. 2021. Available online: https://thehill.com/homenews/sunday-talk-shows/565831-fauci-amount-of-virus-in-breakthrough-delta-cases-almost-identical/ (accessed on 7 April 2023).
- Schwab, C.; Domke, L.M.; Hartmann, L.; Stenzinger, A.; Longerich, T.; Schirmacher, P. Autopsy-based histopathological characterization of myocarditis after anti-SARS-CoV-2-vaccination. Clin. Res. Cardiol. 2023, 112, 431–440. [Google Scholar] [CrossRef] [PubMed]
- Burkhardt, A. Reutlingen Autopsy/Histology Study: Side-Effects from Corona Vaccinations. PowerPoint Conference Presentation (in German). Corona-blog.net. 2022. Available online: https://corona-blog.net/2022/03/10/reutlinger-autopsie-histologie-studie-nebenwirkungen-und-todesfaelle-durch-die-corona-impfungen/ (accessed on 7 April 2023).
- Burkhardt, A. Pathology Conference: Vaccine-Induced Spike Protein Production in the Brain, Organs etc., now Proven. Report24.news. 2022. Available online: https://report24.news/pathologie-konferenz-impfinduzierte-spike-produktion-in-gehirn-u-a-organen-nun-erwiesen/ (accessed on 7 April 2023).
- Domazet-Lošo, T. mRNA Vaccines: Why Is the Biology of Retroposition Ignored? Genes 2022, 13, 719. [Google Scholar] [CrossRef] [PubMed]
- Dopp, K.; Seneff, S. COVID-19 and all-cause mortality data by age group reveals risk of COVID vaccine-induced fatality is equal to or greater than the risk of a COVID death for all age groups under 80 years old as of 6 February 2022. Vixra.org 2022, 21, preprint. [Google Scholar]
- Bajaj, V.; Gadi, N.; Spihlman, A.P.; Wu, S.C.; Choi, C.H.; Moulton, V.R. Aging, Immunity, and COVID-19: How Age Influences the Host Immune Response to Coronavirus Infections? Front. Physiol. 2020, 11, 571416. [Google Scholar] [CrossRef]
- Chen, Y.; Li, C.; Liu, F.; Ye, Z.; Song, W.; Lee, A.C.Y.; Shuai, H.; Lu, L.; To, K.K.; Chan, J.F.; et al. Age-associated SARS-CoV-2 breakthrough infection and changes in immune response in a mouse model. Emerg. Microbes Infect. 2022, 11, 368–383. [Google Scholar] [CrossRef]
- Vo, A.D.; La, J.; Wu, J.T.; Strymish, J.M.; Ronan, M.; Brophy, M.; Do, N.V.; Branch-Elliman, W.; Fillmore, N.R.; Monach, P.A. Factors Associated With Severe COVID-19 Among Vaccinated Adults Treated in US Veterans Affairs Hospitals. JAMA Netw. Open 2022, 5, e2240037. [Google Scholar] [CrossRef]






