Rapporto 86: Prova clinica di Pfizer ‘ Processo 2 ’ Destinatari del vaccino COVID soffrono 2.4 volte gli eventi avversi dei destinatari del placebo; ‘ Processo 2 ’ I flaconcini sono stati contaminati con plasmidi di DNA.
Il processo 2 è stato sempre nascosto nello studio clinico COVID ‘ vaccino ’ di Pfizer e gli investigatori di War Room / DailyClout ’ ne sono convinti. La Food and Drug Administration (FDA) sapeva che i soggetti del Processo 2 avevano livelli molto elevati di eventi avversi, ma non ci sono prove che l’agenzia abbia agito su quei risultati allarmanti.
Hanno avuto un “processo nel processo”
Questo processo 2 ‘ processo nell’ambito di una sperimentazione ’ è stato scoperto all’inizio di quest’anno nelle decine di migliaia di documenti Pfizer rilasciati dalla FDA. I team di DailyClout stavano rivedendo la testimonianza di esperti di Josh Guetzkow, Ph.D. dell’Università Ebraica, Tel Aviv, utilizzato in una causa nel Regno Unito, e ha iniziato a cercare prove dei circa 250 soggetti che potrebbero aver preso parte a un esperimento per conto dell’Agenzia europea per i medicinali (EMA). Ulteriori rapporti del Dr. Guetzkow e Retsef Levi, in a British Medical Journal (BMJ) Lettera di risposta rapida all’editore, ha sottolineato che il protocollo clinico Pfizer modificato (C4591001) nell’ottobre 2020 includeva riferimenti ai processi 1 e 2, nonché a un sottoinsieme di sperimentazione (una sperimentazione all’interno di una sperimentazione) e che no era disponibile la comunicazione pubblica dei risultati: “ La modifica del protocollo afferma che ‘ ogni lotto di ‘ Processo 2′-BNT162b2 prodotto verrebbe somministrato a circa 250 partecipanti di età compresa tra 16 e 55 anni ’ con immunogenicità comparativa e analisi di sicurezza condotte con 250 destinatari batch ‘ Processo 1 ’ selezionati casualmente. Per quanto ne sappiamo, non esiste un rapporto disponibile al pubblico su questo confronto tra ‘ Processo 1 ’ rispetto a ‘ Processo 2 ’ dosi. ”
Il volontario di War Room / DailyClout, la farmacista Erika Delph, ha notato un’anomalia nei numeri di randomizzazione che corrispondeva al numero e alle date di questo processo ‘ allegato all’interno di uno studio. ’ Il nostro team di dati e gli esperti medici hanno analizzato i dati. Ciò che hanno scoperto è scioccante: 502 soggetti erano in un sotto-processo di vaccino Pfizer COVID-19 e hanno ricevuto un farmaco contaminato da livelli inaccettabilmente elevati di plasmidi di DNA. Potrebbe essere allettante cancellarlo come un incidente; tuttavia, le note sulla documentazione mostrano che Pfizer sapeva che stava facendo un’iniezione completamente diversa a 252 sfortunati soggetti di prova rispetto a quella per la quale si erano registrati. Questo fatto da solo viola il Codice di Norimberga (1947), che afferma che è illegale condurre esperimenti umani senza il pieno consenso informato.
Che cos’è il processo 2 e perché tutto il clamore?
I termini ‘ Processo 1 ’ e ‘ Processo 2 ’ sono stati menzionati da Pfizer nelle diverse iterazioni del protocollo di sperimentazione clinica per questa nuova piattaforma di farmaci che sarebbe utilizzata in tutto il mondo. Il processo ‘ ’ si riferisce al modo in cui è stato prodotto il vaccino ‘.
Il processo di fabbricazione originale di BNT162b2, vaccino COVID ‘ di Pfizer, ’ per la sperimentazione clinica ha utilizzato una tecnica di duplicazione dell’RNA messaggero (amplificazione) nota come PCR (reazione a catena della polimerasi) — essenzialmente come una fotocopiatrice, moltiplicando / clonare l’mRNA originale. Questo è noto come ‘ Processo 1 ’.
Commercialmente, questo tipo di processo è costoso e dovrebbe essere notevolmente aumentato per fornire dosi per tutto il mondo. Il ridimensionamento commerciale del prodotto ha utilizzato un modo comprovato di produzione in serie utilizzando e. batteri coli. Questa tecnica di produzione in serie è ‘ Processo 2 ’. Il problema spinoso era che ‘ Processo 2 ’ utilizzava un processo di fabbricazione completamente diverso da quello utilizzato per il prodotto nella sperimentazione clinica (Processo 1), e l’autorizzazione all’uso di emergenza (EUA) per il vaccino ‘ ’ è stata concessa in base al processo 1. Inoltre, Process 2 non era conforme a Good Manufacturing Practice (GMP). Nota i contratti nazionali FOIA con Pfizer di Sudafrica e Albania.
Rivelazioni dal sequenziamento genico del prodotto residuo nelle fiale prodotte utilizzando Process 2 da Kevin McKernan, confermare altri gruppi ’ riferire della determinazione che esiste una marcata contaminazione dell’mRNA modificato con alti livelli di frammenti di plasmide di DNA.
Questa contaminazione è attribuita all’uso di e-coli durante la fabbricazione. Questi batteri si trovano naturalmente nei batteri intestinali umani e sono un mezzo regolare per produrre sequenze di mRNA in serie. Il gene richiesto viene inserito in un anello di DNA e i batteri replicano continuamente questi plasmidi.
I plasmidi prodotti da questo processo vengono purificati utilizzando enzimi ( DNAasi ) e hanno un LIMIT UPPER regolamentato nel prodotto finale a causa delle preoccupazioni teoriche sull’incorporazione di questo DNA nel genoma ospite umano.
Nonostante il principio attivo sia identico nel processo 2 rispetto al processo 1, l’Agenzia europea per i medicinali (EMA) aveva notato il livello di contaminazione da parte dei plasmidi di DNA ed era preoccupato perché era ben al di sopra dei livelli di sicurezza precedentemente pubblicati. L’EMA era sufficientemente preoccupato per chiedere a Pfizer e alla FDA di incorporare il nuovo processo fino alla fine della sperimentazione clinica usando circa 250 soggetti.
Cosa hanno scoperto i volontari di War Room / DailyClout che si nascondeva in bella vista?
Abbiamo identificato una coorte distinta, a causa di numeri di randomizzazione anomali che altrimenti non avevano senso, rispetto alle sequenze utilizzate durante la parte principale della sperimentazione clinica. Abbiamo anche identificato i numeri di lotto anomali che contengono prodotti sviluppati Process 2. Questi 502 soggetti sono stati testati in quattro siti negli Stati Uniti, 250 dei quali hanno agito come soggetti placebo e gli altri 252 che hanno ricevuto il prodotto Process 2. (Grazie a OpenVAET per fornire dati ai volontari di War Room / DailyClout per convalidare i loro risultati sui 252 soggetti del Processo 2.)

Il prodotto aveva un lotto fornitore unico n. ‘EE8493Z’, identificato nel documento di inventario Pfizer Batch / Lot (https://www.phmpt.org/wp-content/uploads/2022/06/125742_S1_M5_5351_c4591001-interim-mth6-patient-batches.pdf).
Anche la coorte è stata separata dai soggetti che hanno ricevuto il Processo 1, nonché dal segmento non cieco dello studio dopo la concessione dell’EUA e in cui praticamente tutto il gruppo placebo dello studio principale ha ricevuto il vaccino ‘ ’.

Zoomando nei dati del Processo 2, la separazione dei soggetti è più facile da vedere.
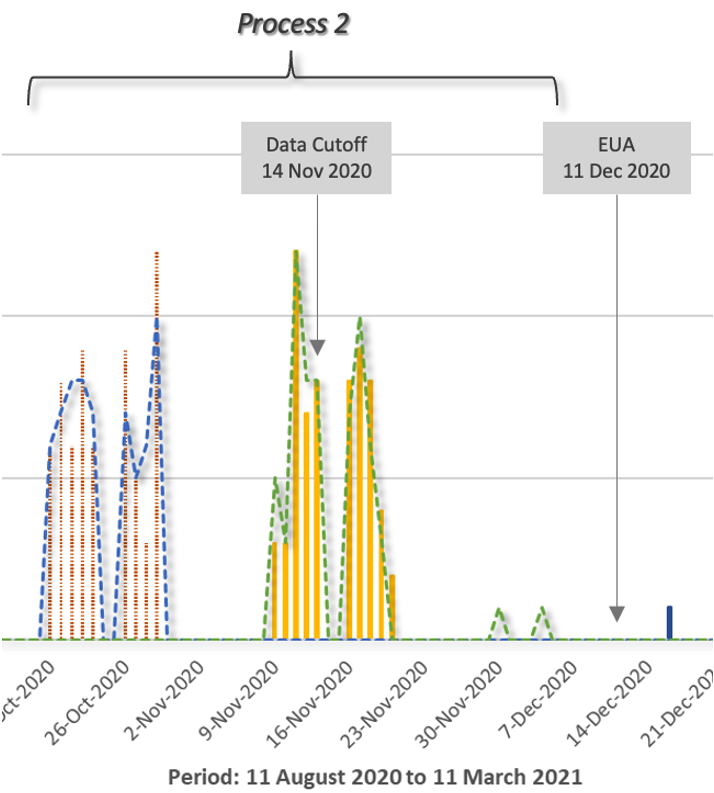
C’era una differenza significativa nel numero di eventi avversi nel gruppo di soggetti di prova del Processo 2, che dovrebbe avere campanelli d’allarme nella testa del regolatore in quanto era molto peggio degli eventi avversi significativi ( AEs ) trovati nella maggior parte degli studi clinici.
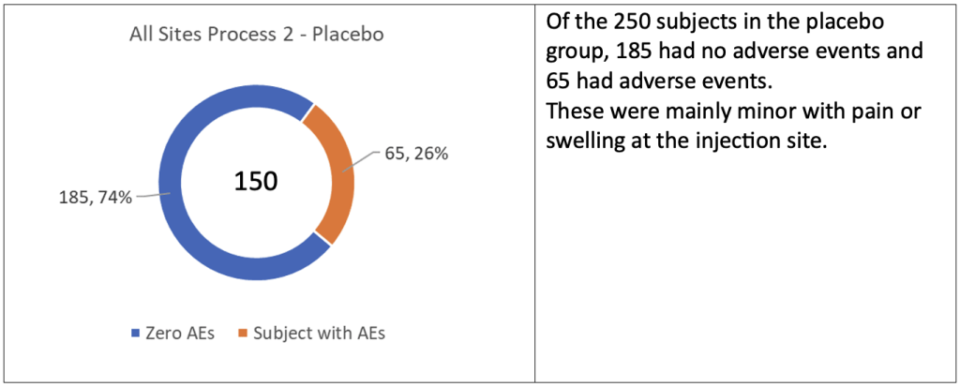

Sebbene gli eventi avversi siano stati minori, esiste una differenza così grande tra il placebo e i bracci di trattamento, 65 contro 155 o 2,4 volte di più, che ci si aspetterebbe un ulteriore controllo per determinare la causa, poiché il NUOVO PROCESSO stava per essere utilizzato per il lancio in tutto il mondo.
Come si confrontano questi risultati con quelli già trovati e riportati da Josh Guetzkow?
La segnalazione fuori dall’Europa si basava su una testimonianza di un lotto di emergenza ‘, ’ EJ0553, utilizzato in 11 soggetti in quattro siti diversi da quelli della mini sperimentazione clinica (siti 1001, 1002, 1003 e 1007). Nel documento del numero di lotto Pfizer, il prodotto Process 2 ha anche una designazione ‘ Z ’ che potrebbe essere stata utilizzata per identificare il prodotto realizzato con il nuovo processo. Per gli Stati Uniti, nessun prodotto fabbricato al di fuori del paese doveva essere utilizzato, ma prove dell’agenzia di regolamentazione australiana, la Therapeutic Goods Administration (TGA) FOI 3659 documento 4, intitolato “ BNT162b2 (PF-07302048) Rapporto di comparabilità per lotti di prodotti farmaceutici PPQ ”, il lotto EJ0553Z è stato prodotto a Puurs, in Belgio, e rilasciato come fornitura di emergenza “ ”.
Le nostre nuove scoperte si basano su prove empiriche trovate nel Documenti Pfizer, già rilasciato.
Di conseguenza, il diversi profili di eventi avversi ha dimostrato che il prodotto di Process 2 era diverso dal prodotto di Process 1. Con quel segnale di sicurezza, la FDA avrebbe dovuto prendere atto e determinare che la sperimentazione clinica avrebbe dovuto essere ripetuta, in quanto è un prodotto diverso con un profilo di sicurezza diverso.
Conclusioni
Il processo 2 avrebbe dovuto essere oggetto di una sperimentazione clinica separata a causa dei segnali di sicurezza del piccolo numero di soggetti testati alla fine della sperimentazione clinica prima che l’EUA fosse approvato. La contaminazione del frammento di plasmide del DNA rilevata è stata più volte superiore al massimo consentito dall’EMA.
I dati trovati nei documenti Pfizer mostrano che i 502 soggetti che hanno costituito la sperimentazione aggiuntiva all’interno di una sperimentazione hanno tutti un segnale di sicurezza marcato a causa di eventi avversi più elevati.
Il processo testato e approvato non è mai stato implementato pubblicamente e dato alla popolazione del mondo. Invece, il pubblico ha ricevuto solo il prodotto Process 2 contaminato dal plasmide del DNA.
Fonte: Dailyclout



